cho 8,4 gam CaCO3 tác dụng với 500ml dung dịch H2SO4 1M đến khi phản ứng xảy ra hoàn toàn. tính nồng độ mol của các chất trong dung dịch sau phản ứng ( coi thể tích dung dịch sau phản ứng vẫn là 500 ml).

Những câu hỏi liên quan
Cho m gam tác dụng với 500ml dung dịch H2SO4 1M. Sau phản ứng xảy ra hoàn toàn thu được 6,72 lít H2(đktc) và dung dịch A. - Tìm m - Tính nồng độ các chất trong A?
Câu 2: Cho 200ml dung dịch KOH 1M tác dụng với 300ml dung dịch H2SO4 1M.
a/ Viết PTHH của phản ứng xảy ra?
b/ Tính khối lượng chất dư sau Phản ứng?
c/ Tính thể tích dung dịch sau phản ứng?
d/ Tính nồng độ mol của các chất trong dung dịch sau phản ứng
a/ \(n_{KOH}=0,2.1=0,2\left(mol\right);n_{H_2SO_4}=0,3.1=0,3\left(mol\right)\)
PTHH: 2KOH + H2SO4 → K2SO4 + 2H2O
Mol: 0,2 0,1 0,1
Ta có: \(\dfrac{0,2}{2}< \dfrac{0,3}{1}\) ⇒ KOH hết, H2SO4 dư
b/ \(m_{H_2SO_4dư}=\left(0,3-0,1\right).98=19,6\left(g\right)\)
c/ Vdd sau pứ = 0,2 + 0,3 = 0,5 (l)
d/ \(C_{M_{ddK_2SO_4}}=\dfrac{0,1}{0,5}=0,2M\)
\(C_{M_{ddH_2SO_4dư}}=\dfrac{0,3-0,1}{0,5}=0,4M\)
Đúng 4
Bình luận (0)
Cho 6,5 g kẽm vào 300ml dung dịch H2SO4 loãng có nồng độ 1M
a. Viết phương trình phản ứng xảy ra.
b. Tính số mol các chất có trong dung dịch sau phản ứng.
c. Tính nồng độ mol của các chất sau phản ứng. Coi thể tích dung dịch không đổi.
Help. Mai thi hóa r :(
\(n_{Zn}=\dfrac{6.5}{65}=0.1\left(mol\right)\)
\(n_{H_2SO_4}=0.3\cdot1=0.3\left(mol\right)\)
\(Zn+H_2SO_4\rightarrow ZnSO_4+H_2\)
\(0.1........0.1...........0.1.......0.1\)
\(\Rightarrow H_2SO_4dư\)
\(n_{H_2SO_4\left(dư\right)}=0.3-0.1=0.2\left(mol\right)\)
\(n_{ZnSO_4}=n_{H_2}=0.1\left(mol\right)\)
\(C_{M_{ZnSO_4}}=\dfrac{0.1}{0.3}=0.33\left(M\right)\)
\(C_{M_{H_2SO_4\left(dư\right)}}=\dfrac{0.2}{0.3}=0.66\left(M\right)\)
Đúng 2
Bình luận (0)
\(a) Zn + H_2SO_4 \to ZnSO_4 + H_2\\ b) n_{Zn} = \dfrac{6,5}{65} = 0,1 < n_{H_2SO_4} =0,3 \to H_2SO_4\ dư\\ n_{H_2SO_4\ pư} = n_{ZnSO_4} = n_{Zn} = 0,1(mol)\\ n_{H_2SO_4\ dư} = 0,3 - 0,1 = 0,2(mol)\\ c) C_{M_{ZnSO_4}} = \dfrac{0,1}{0,3} = 0,33M\\ C_{M_{H_2SO_4}} = \dfrac{0,2}{0,3} = 0,67M\)
Đúng 0
Bình luận (0)
\(n_{Zn}=\dfrac{m}{M}=0,1\left(mol\right)\)
\(n_{H2SO4}=C_M.V=0,3\left(mol\right)\)
a, \(PTHH:Zn+H_2SO_4\rightarrow ZnSO_4+H_2\)
b, Thấy 0,3 > 0,1
=> Sau phản ứng Zn hết, H2SO4 còn dư ( dư 0,3 - 0,1 = 0,2 mol )
- Theo PTHH : \(n_{ZnSO4}=n_{Zn}=0,1\left(mol\right)\)
c, Ta có : \(\left\{{}\begin{matrix}C_{MH2SO4}=\dfrac{n}{V}=\dfrac{2}{3}M\\C_{MZnSO4}=\dfrac{n}{V}=\dfrac{1}{3}M\end{matrix}\right.\)
Đúng 0
Bình luận (0)
Cho 3,6 gam kim loại Mg vào 250 ml dung dịch FeCl3 1M. Sau khi phản ứng xảy ra hoàn toàn thu được m gam chất rắn và dung dịch X. Tính m và nồng độ mol của các chất trong dung dịch X ( xem như thể tích dung dịch sau phản ứng không đổi) ?
nMg = 3,6/24 = 0,15 mol; nFeCl3 = 0,25.1 = 0,25 mol
Mg + 2FeCl3 → MgCl2 + 2FeCl2
0,125dư 0,025←0,25 → 0,125 → 0,25 (mol)
Mg + FeCl2 → MgCl2 + Fe
0,025→0,025 →0,025→0,025 (mol)
Vậy chất rắn sau phản ứng là Fe: nFe = 0,025 mol
=> m = mFe = 0,025.56 = 1,4 (gam)
Dung dịch X sau phản ứng gồm:
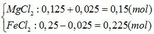
Nồng độ của các chất trong dung dịch X:
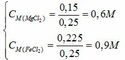
Đúng 0
Bình luận (0)
Cho 50ml dung dịch H2SO4 2M tác dụng với 50ml dung dịch BaCl2 1M . Tính nồng độ mol của các chất tạo thành sau khi phản ứng xảy ra hoàn toàn . Hộ mình với mn
\(n_{H_2SO_4}=0,05.2=0,1\left(mol\right)\\ n_{BaCl_2}=0,05.1=0,05\left(mol\right)\\ BaCl_2+H_2SO_4\rightarrow BaSO_4\downarrow+2HCl\\ Vì:\dfrac{0,05}{1}< \dfrac{0,1}{1}\\ \Rightarrow H_2SO_4dư\\ n_{H_2SO_4\left(p.ứ\right)}=n_{BaCl_2}=0,05\left(mol\right)\\ n_{H_2SO_4\left(dư\right)}=0,1-0,05=0,05\left(mol\right)\\ n_{NaCl}=2.0,05=0,1\left(mol\right)\\ V_{ddsau}=0,05+0,05=0,1\left(l\right)\\ C_{MddNaCl}=\dfrac{0,1}{0,1}=1\left(M\right)\\ C_{MddH_2SO_4\left(dư\right)}=\dfrac{0,05}{0,1}=0,5\left(M\right)\)
Đúng 0
Bình luận (1)
Cho m gam hỗn hợp X gồm Na và K (tỉ lệ mol 1 : 1) vào 500 ml dung dịch chứa hỗn hợp gồm Al2(SO4)3 0,5M và H2SO4 1M sau khi phản ứng xảy ra hoàn toàn thu được dung dịch Y. Cho dung dịch Y tác dụng với 1,5 lít dung dịch HCl 1M, sau khi phản ứng xảy ra hoàn toàn thu được 23,4 gam kết tủa. Giá trị nhỏ nhất của m là A. 130,2 gam B. 27,9 gam C. 105,4 gam D. 74,4 gam
Đọc tiếp
Cho m gam hỗn hợp X gồm Na và K (tỉ lệ mol 1 : 1) vào 500 ml dung dịch chứa hỗn hợp gồm Al2(SO4)3 0,5M và H2SO4 1M sau khi phản ứng xảy ra hoàn toàn thu được dung dịch Y. Cho dung dịch Y tác dụng với 1,5 lít dung dịch HCl 1M, sau khi phản ứng xảy ra hoàn toàn thu được 23,4 gam kết tủa. Giá trị nhỏ nhất của m là
A. 130,2 gam
B. 27,9 gam
C. 105,4 gam
D. 74,4 gam
Cho 12,0 g CaCO3 tác dụng với 200 ml dung dịch HCl 3M, sau khi phản ứng xảy ra hoàn toàn thu được dd X và V lít CO2 (đktc).
a) Tính V
b) Tính nồng độ mol của các ion trong dd X (coi thể tích dung dịch thay đổi không đáng kể và CO2 không tan trong nước)
a)
$n_{CaCO_3} = 0,12(mol) ; n_{HCl} = 0,6(mol)
\(CaCO_3+2HCl\text{→}CaCl_2+CO_2+H_2O\)
Ban đầu 0,12 0,6 (mol)
Phản ứng 0,12 0,24 (mol)
Sau pư 0 0,36 0,12 (mol)
$V = 0,12.22,4 = 2,688(lít)$
b)
$n_{Cl^-} = 0,6(mol) ; n_{H^+} = 0,36(mol)$
$n_{Ca^{2+}} = 0,12(mol)$
$[Cl^-] = \dfrac{0,6}{0,2} = 3M$
$[H^+] = \dfrac{0,36}{0,2} = 1,8M$
$[Ca^{2+}] = \dfrac{0,12}{0,2} = 0,6M$
Đúng 2
Bình luận (1)
a,\(n_{CaCO_3}=\dfrac{12}{100}=0,12\left(mol\right);n_{HCl}=0,2.3=0,6\left(mol\right)\)
PTHH: CaCO3 + 2HCl → CaCl2 + CO2 + H2O
Mol: 0,12 0,12
Ta có: \(\dfrac{0,12}{1}< \dfrac{0,6}{2}\)⇒ HCl dư,CaCO3 pứ hết
\(V_{CO_2}=0,12.22,4=2,688\left(l\right)\)
Đúng 0
Bình luận (0)
Cho 31,6 gam KMnO4 tác dụng hết với dung dịch HCl đặc, dư và đun nóng thu được một lượng khí X. Dẫn toàn bộ khí X vào 1 lít dung dịch KOH 2M trong điều kiện thích hợp để phản ứng xảy ra hoàn toàn, thu được dung dịch Y. Viết các phương trình phản ứng xảy ra và tính nồng độ mol các chất có trong dung dịch Y (giả thiết rằng thể tích dung dịch sau phản ứng thay đổi không đáng kể).
Đọc tiếp
Cho 31,6 gam KMnO4 tác dụng hết với dung dịch HCl đặc, dư và đun nóng thu được một lượng khí X. Dẫn toàn bộ khí X vào 1 lít dung dịch KOH 2M trong điều kiện thích hợp để phản ứng xảy ra hoàn toàn, thu được dung dịch Y. Viết các phương trình phản ứng xảy ra và tính nồng độ mol các chất có trong dung dịch Y (giả thiết rằng thể tích dung dịch sau phản ứng thay đổi không đáng kể).
– Số mol KMnO4 = 0,2 (mol); số mol KOH = 2 (mol)
– Phương trình phản ứng:
2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2 + 8H2O
0,2 0,5
* Ở điều kiện nhiệt độ thường:
Cl2 + 2KOH → KCl + KClO + H2O
0,5 1,0 0,5 0,5
– Dư 1,0 mol KOH
CM (KCl) = CM (KClO) = 0,5 (M); CM (KOH dư) = 1 (M)
* Ở điều kiện đun nóng trên 700C:
3Cl2 + 6KOH → 5KCl + KClO3 + 3H2O
0,5 1,0 5/6 1/6
– Dư 1,0 mol KOH
CM (KCl) = 5/6 (M); CM (KClO3) = 1/6 (M); CM (KOH dư) = 1 (M).
Đúng 0
Bình luận (0)
Cho 8,4 gam bột sắt vào 270 gam dung dịch CuCl2 10% (d = 1,35 g/ml), khi đến phản ứng xảy ra hoàn toàn thu được a gam chất rắn và dung dịch A.
a) Viết PTPƯ, tính a?
b) Tính C% của dung dịch A.
c) Xác định nồng độ mol/lít của dd A (coi thể tích dung dịch thay đổi không đáng kể)
\(n_{Fe}=\dfrac{8,4}{56}=0,15mol\)
\(m_{CuCl_2}=\dfrac{270\cdot10\%}{100\%}=27g\Rightarrow n_{CuCl_2}=0,2mol\)
\(Fe+CuCl_2\rightarrow FeCl_2+Cu\)
0,15 0,2 0,15 0,15
\(a=m_{Cu}=0,15\cdot64=9,6g\)
\(m_{FeCl_2}=0,15\cdot127=19,05g\)
\(m_{ddFeCl_2}=8,4+270-0,15\cdot64=268,8g\)
\(C\%=\dfrac{19,05}{268,8}\cdot100\%=7,09\%\)
Đúng 3
Bình luận (0)






















