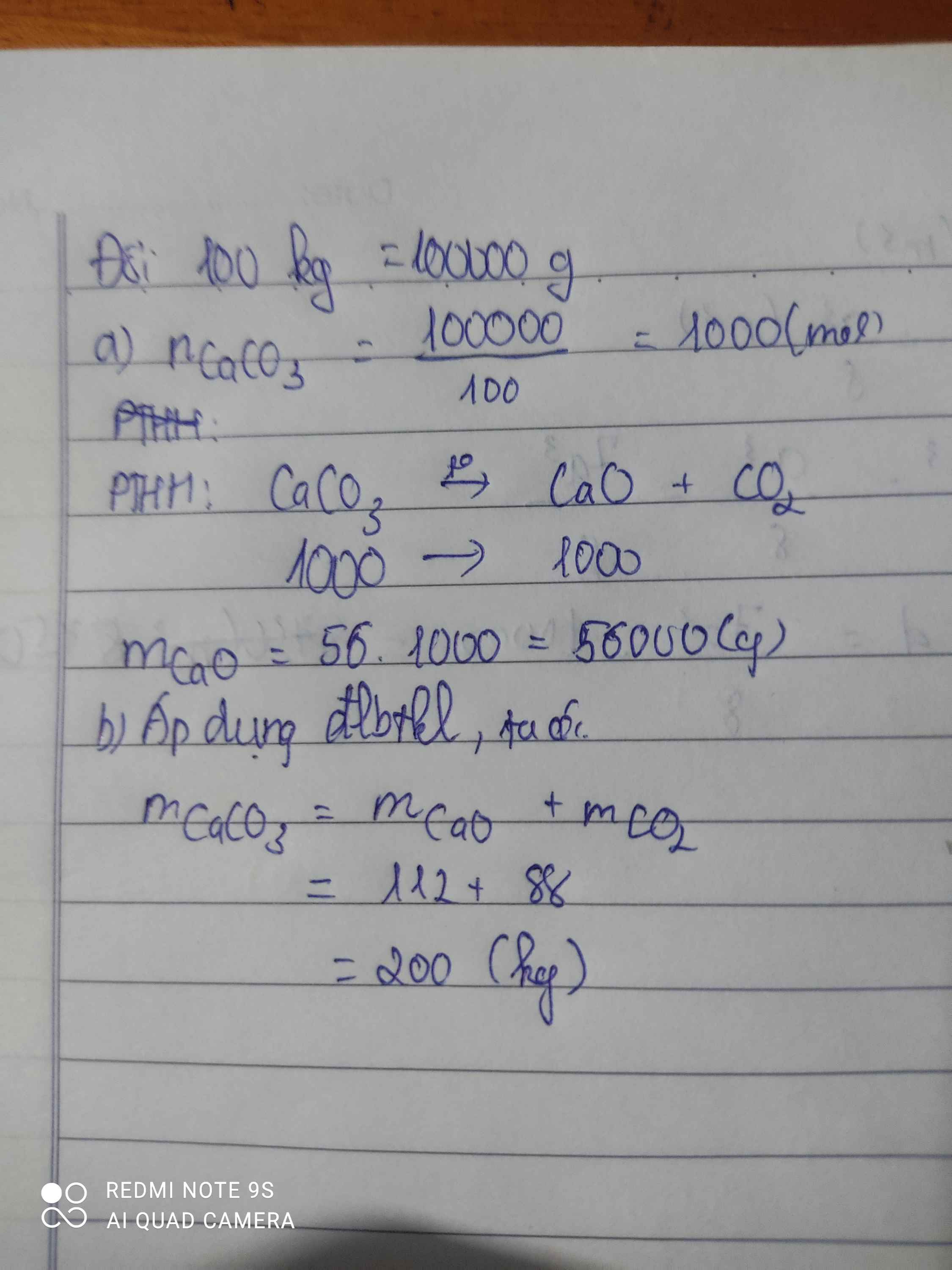gốc \(HCO^-_3\) có phân hủy ra \(CO^{2-}_3\) ở nhiệt độ thường ko

Những câu hỏi liên quan
Nhiệt phân a tấn CaCO_3 theo sơ đồ phản ứng sau: CaCO_3rightarrowCaO + CO_2Sau khi phản ứng kết thúc thu được hỗn hợp chất rắn X.Biết hiệu suất phân hủy là 80%. Tổng số electron trong hỗn hợp chất rắn X thu được là 1,944.10^{29} (e). Tìm a, cho biết số proton của một số nguyên tố là: Ca:20, C:6, O:8Giải chi tiết hộ e với ạ.
Đọc tiếp
Nhiệt phân a tấn CaCO\(_3\) theo sơ đồ phản ứng sau: CaCO\(_3\)\(\rightarrow\)CaO + CO\(_2\)
Sau khi phản ứng kết thúc thu được hỗn hợp chất rắn X.Biết hiệu suất phân hủy là 80%. Tổng số electron trong hỗn hợp chất rắn X thu được là 1,944.10\(^{29}\) (e). Tìm a, cho biết số proton của một số nguyên tố là: Ca:20, C:6, O:8'
Giải chi tiết hộ e với ạ.
Số electron trong CaCO3 : 20 + 6 + 8.3 = 50(electron)
Số electron trong CO2 : 6 + 8.2 = 22(electron)
Gọi \(n_{CaCO_3} = x(mol)\)
\(n_{CO_2} = n_{CaCO_3\ pư} = x.80\% = 0,8x(mol)\)
Ta có :
\(n_{e(trong\ CaCO_3)} = n_{e(trong\ X)} + n_{e(trong\ CO_2)}\\ \Leftrightarrow 50x = \dfrac{1,944.10^{29}}{6.10^{23}} + 22x\\ \Leftrightarrow x = 10 000\\ \Rightarrow a = 10 000.100 = 10^6(gam) = 1(tấn)\)
Đúng 2
Bình luận (0)
a) Sắp xếp theo chiều tăng dần số nguyên tử oxi có trong x gam mỗi chất sau: KNO_3, Fe_2O_3, SO_3, BaSO_4.b) Sắp xếp theo chiều giảm dần số nguyên tử oxi có trong V lít mỗi khí sau: NO_2, SO_3, CO ở cùng nhiệt độ và áp suất.
Đọc tiếp
a) Sắp xếp theo chiều tăng dần số nguyên tử oxi có trong x gam mỗi chất sau: KNO\(_3\), Fe\(_2\)O\(_3\), SO\(_3\), BaSO\(_4\).
b) Sắp xếp theo chiều giảm dần số nguyên tử oxi có trong V lít mỗi khí sau: NO\(_2\), SO\(_3\), CO ở cùng nhiệt độ và áp suất.
Dựa vào PTHH nhiệt phân: CaCO\(_3\) + CaO + CO\(_2\)
a, Tính khối lượng CaO tạo thành khí nung 100Kg CaCO\(_3\)
b, Nếu thu được 112kg CaO và 88kg CO\(_2\) thì khối lượng đá vôi (CaCO\(_3\)) tham gia là bao nhiêu?
a)n CaCO3=\(\dfrac{100}{100}\)=1 mol
CaCO3-to>CaO+CO2
1--------------1 mol
=>m CaO=1.56=56g
b) Áp dụng định luật bảo toàn khối lượng :
m CaCO3=m CaO+m CO2
m CaCO3=112+88=200g
Đúng 1
Bình luận (1)
Câu 2. Lập các PTHH sau và cho biết phản ứng nào là phản ứng phân hủy? Phản ứng nào là phản ứng hóa hợp? Vì sao? a. KClO_3 underrightarrow{t} KCL + O2b.CaCO_3underrightarrow{t} CaO + CO_2c.Fe + HCl rightarrow FeCl_2 + H_2d.H_2 + O_2 rightarrow H_2Oe.Fe(OH)_3 rightarrow Fe_2O_3 + H_2Of.Na_2O + H_2O rightarrow NaOH
Đọc tiếp
Câu 2. Lập các PTHH sau và cho biết phản ứng nào là phản ứng phân hủy? Phản ứng nào là phản ứng hóa hợp? Vì sao? a. KClO\(_3\) \(\underrightarrow{t}\) KCL + O2
b.CaCO\(_3\)\(\underrightarrow{t}\) CaO + CO\(_2\)
c.Fe + HCl \(\rightarrow\) FeCl\(_2\) + H\(_2\)
d.H\(_2\) + O\(_2\) \(\rightarrow\) H\(_2\)O
e.Fe(OH)\(_3\) \(\rightarrow\) Fe\(_2\)O\(_3\) + H\(_2\)O
f.Na\(_2\)O + H\(_2\)O \(\rightarrow\) NaOH
\(a) 2KClO_3 \xrightarrow{t^o} 2KCl + 3O_2\\ b) CaCO_3 \xrightarrow{t^o} CaO + CO_2\\ c) Fe + 2HCl \to FeCl_2 + H_2\\ d) 2H_2 + O_2 \xrightarrow{t^o} 2H_2O\\ e) 2Fe(OH)_3 \xrightarrow{t^o} Fe_2O_3 + 3H_2O\\ f) Na_2O + H_2O \to 2NaOH\)
- Phản ứng phân hủy : a,b,e
- Phản ứng thế: c
- Phản ứng hóa hợp : d,f
Đúng 3
Bình luận (0)
Phản ứng hóa hợp : từ hai hay nhiều chất sinh ra một chất mới
H2 + 1/2O2 -to-> H2O
Na2O + H2O => 2NaOH
Phản ứng phân hủy : từ một chất sinh ra hai hay nhiều chất mới.
2KClO3 -to-> 2KCl + 3O2
CaCO3 -to-> CaO + CO2
2Fe(OH)3 -to-> Fe2O3 + 3H2O
Đúng 2
Bình luận (0)
giải hộ mk vs ạ mk đang cần gấp
cho các chất sau CaH\(_2\)CO\(_3\),Ca(HCO\(_3\))\(_2\),CaCO\(_3\),NaCO\(_3\),NaSO\(_3\),CO\(_2\),CaO chất nào tác dụng đc vs HCl ,viết PTHH
Ca(HCO3)2 + 2HCl --->CaCl2 + 2CO2 + H2O
CaCO3 + 2HCl --->CaCl2 + 2CO2 + H2O
4HCl + CO2 ---> CCl4 + 2H2O
CaO + 2HCl --->CaCl2 + H2O
Đúng 0
Bình luận (0)
hãy phân loại các chất:
KNO\(_3\)
FeCL\(_2\)
HCL
Na\(_2\)CO\(_3\)
NaHCO\(_3\)
Mg(OH)\(_2\)
Muối: KNO3, FeCl2, Na2CO3, NaHCO3
Axit: HCl
Bazơ: Mg(OH)2
Đúng 2
Bình luận (0)
Có thể tồn tại đồng thời các dd chứa đồng thời từng nhóm các ion sau hay ko? Giải thích bằng pt ion (nếu có)
a) \(HCO^-_3,K^+,Ca^{2+},H^+\)
b) \(HCO^-_3,Na^+,Ba^{2+},OH^-\)
c) \(Fe^{2+},Cl^-,NO_3^-,S^{2-}\)
d) \(Br^-,NH_4^+,Ag^+,Ca^{2+}\)
hãy tính % theo khối lượng của nguyên tố có trong phản ứng trong hợp chất:
a) NaNO\(_3\)
b) Al\(_2\)(CO\(_3\))\(_3\)
c) NH\(_4\)NO\(_3\)
\(a,\%Na=\dfrac{23}{85}.100\%=27,06\%\\ \%N=\dfrac{14}{85}.100\%=16,47\%\\ \%O=100\%-27,06\%-16,47\%=56,47\%\\ b,\%Al=\dfrac{54}{234}.100\%=27,1\%\\ \%C=\dfrac{36}{234}.100\%=15,4\%\\ \%O=100\%-27,1\%-15,4\%=57,5\%\)
\(c,\%N=\dfrac{28}{79}.100\%=35,4\%\\ \%H=\dfrac{4}{79}.100\%=5,1\%\\ \%O=100\%-35,4\%-5,1\%=59,5\%\)
Đúng 3
Bình luận (1)
\(M_{NaNO_3}=23+14+16.3=85\left(\dfrac{g}{mol}\right)\\ \Rightarrow\%m_{Na}=\dfrac{23.100\%}{85}=27\%\\ \%m_N=\dfrac{14.100\%}{85}=16,47\%\\ \Rightarrow\%m_O=100\%-\left(16,47\%+27\%\right)=56,53\)
Đúng 2
Bình luận (0)
Ở 20C. Khi hòa tan 60 gam KNO\(_3\) vào 190g nước thì thu được dung dịch bão hòa. Tính độ tan của KNO\(_3\) ở nhiệt độ đó ?
cứ 190g nước hòa tan được 60g KNO3
100g nước hào tan được x g KNO3
\(\Rightarrow\) x= \(\dfrac{100.60}{190}\)\(\approx\) 31,58g
Đúng 0
Bình luận (0)
S = \(\dfrac{60}{190}.100\%\)= 31,58g
Đúng 0
Bình luận (0)