Hãy tính các khối lượng sau ra gam: mBe= 9,012u ; mO= 15,999u

Những câu hỏi liên quan
Beri có khối lượng nguyên tử bằng: mBe 9,012u. Khối lượng đó tính ra gam là A. 9,012 gam B. 14,964 gam C. 14,964.10-24 gam D. 14,964.1024
Đọc tiếp
Beri có khối lượng nguyên tử bằng: mBe = 9,012u. Khối lượng đó tính ra gam là
A. 9,012 gam
B. 14,964 gam
C. 14,964.10-24 gam
D. 14,964.1024
Chọn C.
Ta có: u = 1,6605.10-24 gam nên mBe = 9,012.1,6605.10-24 = 14,964.10-24 gam
Đúng 0
Bình luận (0)
Beri và oxi lần lượt có khối lượng nguyên tử bằng :
m
Be
9,012u;
m
O
15,999u.Khối lượng nguyên tử beri và oxi tính theo g lần lượt làA. 14,964.
10
-
24
g và 26.566.
10
-
24
gB. 26,566....
Đọc tiếp
Beri và oxi lần lượt có khối lượng nguyên tử bằng :
m Be = 9,012u; m O =15,999u.
Khối lượng nguyên tử beri và oxi tính theo g lần lượt là
A. 14,964. 10 - 24 g và 26.566. 10 - 24 g
B. 26,566. 10 - 24 g và 14,964. 10 - 24 g
C. 15. 10 - 24 g và 26. 10 - 24 g
D. 9g và 16g
Các nguyên tử sau có nguyên tử khối lần lượt bằng:
Ne= 21,179u; Mg= 24u; He= 4,0026 u ; S= 32,06 u . Hãy tính các khối lượng đó ra gam.
\(m_{Ne}=21,179.0,16605.10^{-23}=3,51677295.10^{-23}\left(g\right)\\ m_{Mg}=24.0,16605.10^{-23}=3,9852.10^{-23}\left(g\right)=3,9852.10^{-23}\left(g\right)\\ m_{He}=4,0026.0,16605.10^{-23}=0,66463173.10^{-23}\left(g\right)\\ m_S=32,06.0,16605.10^{-23}=5,323563.10^{-23}\left(g\right)\)
Đúng 0
Bình luận (0)
Cho 5,6 gam Sắt vào 100ml dung dịch HCl 1M. Hãy: a, Tính khối lượng H2 tạo ra ở đktc b, Chất nào còn dư sau phản ứng và lượng dư là bao nhiêu? c, Tính khối lượng các chất thu được sau phản ứng
\(n_{Fe}=\dfrac{5,6}{56}=0,1\left(mol\right)\)
\(n_{HCl}=0,1.1=0,1\left(mol\right)\)
PTHH :
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
Trc p/u: 0,1 0,1
p/u : 0,05 0,1 0,05 0,05
Sau p/u : 0,05 0 0,05 0,05
-> Fe dư sau p/u
a) \(m_{H_2}=0,05.2=0,1\left(g\right)\)
b) sau p/ư Fe dư
\(m_{Fedư}=0,05.2,8\left(g\right)\)
c) \(m_{FeCl_2}=0,05.\left(56+35,5.2\right)=6,35\left(g\right)\)
Đúng 1
Bình luận (0)
Ngâm lá sắt có khối lượng 56 gam vào dung dịch AgNO3, sau một thời gian lấy lá sắt ra rửa nhẹ cân được 57,6 gam. Hãy tính khối lượng Ag sinh ra sau phản ứng?
\(m_{tăng}=57,6-56=1,6\left(g\right)=m_{Ag}\)
Đúng 1
Bình luận (0)
\(Fe+2AgNO_3->Fe\left(NO_3\right)_2+2Ag\\ \Delta m=1,6=n_{Ag}\cdot108-0,5n_{Ag}\cdot56\\ n_{Ag}=0,02\\ m_{Ag}=2,16g\)
Đúng 0
Bình luận (0)
Để tráng bạc một số ruột phích, người ta phải thủy phân 100 gam saccarozơ, sau đó tiến hành phản ứng tráng bạc. Hãy viết các phương trình phản ứng xảy ra, tính khối lượng AgNO3 cần dùng và khối lượng Ag tạo ra. Giả thiết các phản ứng xảy ra hoàn toàn.
Số mol saccarozo 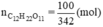

C5H11O5CHO + 2AgNO3 + 3NH3 + H2O 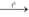 C5H11O5COONH4 + 2Ag + 2NH4NO3
C5H11O5COONH4 + 2Ag + 2NH4NO3
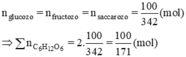
Cả glucozo và fructozo cùng tham gia phản ứng tráng gương
⇒ nAgNO3 = nAg = 2. nC6H12O6 = 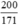 mol
mol
Khối lượng Ag sinh ra và khối lượng AgNO3 cần dùng là
mAg = 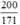 . 108 = 126,3 (g)
. 108 = 126,3 (g)
m(AgNO3) = 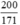 . 170 = 198,8(g)
. 170 = 198,8(g)
Đúng 0
Bình luận (0)
Để tráng bạc một số ruột phích, người ta phải thủy phân 100 gam saccarozơ, sau đó tiến hành phản ứng tráng bạc. Hãy viết các phương trình hoá học của phản ứng xảy ra, tính khối lượng AgNO3 cần dùng và khối lượng Ag tạo ra. Giả thiết rằng các phản ứng xảy ra hoàn toàn.
\(n_{C_{12}H_{22}O_{11}}=\dfrac{100}{342}=\dfrac{50}{171}\left(mol\right)\)
\(C_{12}H_{22}O_{11}+H_{2}O\) \(\underrightarrow{t^o,xt}\) \(C_6H_{12}O_6\left(glucozo\right)+C_6H_{12}O_6\left(fructozo\right)\)
\(n_{glucozo}=n_{fructozo}=n_{saccarozo}=\dfrac{50}{171}\left(mol\right)\)
\(\Sigma n_{C_6H_{12}O_6}=\dfrac{50}{171}+\dfrac{50}{171}=\dfrac{100}{171}\left(mol\right)\)
Ta có: \(n_{Ag}=2.\Sigma n_{C_6H_{12}O_6}=2.\dfrac{100}{171}=\dfrac{200}{171}\left(mol\right)\)
\(\Rightarrow m_{Ag}=108.\dfrac{200}{171}\approx126,316\left(g\right)\)
\(m_{AgNO_3}=\dfrac{200}{171}.170\approx198,83\left(g\right)\)
Đúng 2
Bình luận (2)
Cho 3,25 gam bột kim loại kẽm tác dụng với 50g dung dich axit clohiđric 14,6%. Hãy tính :
a. Thể tích khí H2 sinh ra (ở đktc).
b. Khối lượng các chất tan có trong dung dịch sau phản ứng.
c. Khối lượng của dung dịch sau phản ứng.
d. Nồng độ phần trăm các chất trong dung dịch sau phản ứng.
\(n_{Zn}=\dfrac{3,25}{65}=0,05\left(mol\right)\)
\(m_{ct}=\dfrac{14,6.50}{100}=7,3\left(g\right)\)
\(n_{HCl}=\dfrac{7,3}{36,5}=0,2\left(mol\right)\)
Pt : \(Zn+2HCl\rightarrow ZnCl_2+H_2|\)
1 2 1 1
0,05 0,2 0,05 0,05
a) Lập tỉ số so sánh : \(\dfrac{0,05}{1}< \dfrac{0,2}{2}\)
⇒ Zn phản ứng hết , HCl dư
⇒ Tính toán dựa vào số mol của Zn
\(n_{H2}=\dfrac{0,05.1}{1}=0,05\left(mol\right)\)
\(V_{H2\left(dktc\right)}=0,05.22,4=1,12\left(l\right)\)
b) \(n_{ZnCl2}=\dfrac{0,05.1}{1}=0,05\left(mol\right)\)
⇒ \(m_{ZnCl2}=0,05.136=6,8\left(g\right)\)
\(n_{HCl\left(dư\right)}=0,2-\left(0,5.2\right)=0,1\left(mol\right)\)
⇒ \(m_{HCl\left(dư\right)}=01,.36,5=3,65\left(g\right)\)
c) \(m_{ddspu}=3,25+50-\left(0,05.2\right)=53,15\left(g\right)\)
\(C_{ZnCl2}=\dfrac{6,8.100}{53,15}=12,8\)0/0
\(C_{HCl\left(dư\right)}=\dfrac{3,65.100}{53,15}=6,88\)0/0
Chúc bạn học tốt
Đúng 1
Bình luận (2)
a)
$n_{Zn} = \dfraac{3,25}{65} = 0,05(mol) ; n_{HCl} = \dfrac{50.14,6\%}{36,5} = 0,2(mol)$
$Zn +2 HCl \to ZnCl_2 + H_2$
$n_{Zn} : 1 < n_{HCl} : 2$ nên HCl dư
$n_{H_2} = n_{Zn} = 0,05(mol)$
$V_{H_2} = 0,05.22,4 = 1,12(lít)$
b)
$n_{ZnCl_2} = n_{Zn} = 0,05 \Rightarrow m_{ZnCl_2} = 0,05.136 = 6,8(gam_$
$n_{HCl\ pư} = 2n_{Zn} = 0,1(mol) \Rightarrow m_{HCl\ dư} = (0,2 - 0,1).36,5 = 3,65(gam)$
c)
$m_{dd\ sau\ pư} = 3,25 + 50 - 0,05.2 = 53,15(gam)$
d)
$C\%_{ZnCl_2} = \dfrac{6,8}{53,15}.100\%= 12,8\%$
$C\%_{HCl} = \dfrac{3,65}{53,15}.100\% = 6,87\%$
Đúng 1
Bình luận (0)
Ngâm lá sắt có khối lượng 56 gam vào dung dịch AgNO3, sau một thời gian lấy lá sắt ra rửa nhẹ cân được 57,6 gam. Hãy tính khối lượng Ag sinh ra sau phản ứng? ( Cho: N = 14, Na = 23, Cu = 64, Zn = 65, Ag = 108, O = 16 )
F e + 2 A g N O 3 → F e ( N O 3 ) 2 + 2 A g (0,25 điểm)
1 mol Fe phản ứng tạo thành 2 mol Ag thì khối lượng tăng thêm là: 2.108 – 56 = 160g (0,25 điểm)
Theo bài: m tăng = 57,6 – 56 = 1,6 g
⇒ n F e p ư = 1,6/160 = 0,1 mol
n A g = 2 . n F e = 0,1.2 = 0,2 mol
m A g = 0,2 .108 = 21,6 g (0,5 điểm)
Đúng 0
Bình luận (0)


















