Cho 2,7 gam

Những câu hỏi liên quan
Hòa tan hoàn toàn 2,7 gam hỗn hợp X gồm Fe, Cr, A1 bằng dung dịch HC1 dư, thu được 1,568 lít khí H2 (dktc). Mặt khác, cho 2,7 gam X phản ứng hoàn toàn với khi C12 dư, thu được 9,09 gam muối. Khối lượng A1 trong 2,7 gam X là bao nhiêu? A.1,08 gam. B. 0,54 gam. C. 0,81 gam. D. 0,27 gam.
Đọc tiếp
Hòa tan hoàn toàn 2,7 gam hỗn hợp X gồm Fe, Cr, A1 bằng dung dịch HC1 dư, thu được 1,568 lít khí H2 (dktc). Mặt khác, cho 2,7 gam X phản ứng hoàn toàn với khi C12 dư, thu được 9,09 gam muối. Khối lượng A1 trong 2,7 gam X là bao nhiêu?
A.1,08 gam.
B. 0,54 gam.
C. 0,81 gam.
D. 0,27 gam.
Đáp án B
![]()
Cr và Fe khi phản ứng với dd HC1 thì lên số oxi hóa +2, khi phản ứng với C12 lên số oxi hóa +3.
Hệ phương trình
Tổng khối lượng kim loại:
56x + 52y + 27z = 2,7
Bảo toàn e:
2x + 2y + 32 = 2.1,568/22,4
=> x = y = z = 0,02
=> mA1=0,02.27 = 0,54
Khối lượng muối:
3x + 3y + 3z = (9,09-2,7)/35,5
Đúng 0
Bình luận (0)
Câu 12. Hòa tan hoàn toàn 2,7 gam hỗn hợp X gồm Fe, Cr, Al bằng dung dịch HCl dư, thu được 1,568 lít khí H2 (đktc). Mặt khác, cho 2,7 gam X phản ứng hoàn toàn với khí Cl2 dư, thu được 9,09 gam muối. Tính khối lượng Al có trong 2,7 gam X?
nH2 = 1,56822,41,56822,4= 0,07 (mol)
Gọi a,b,c lần lượt là số mol của Fe,Cr,Al
PTHH:
Fe + 2HCl ----> FeCl2 + H2↑↑
a mol------------------->a mol
Cr + 2HCl ----> CrCl2 + H2↑↑
b mol--------------------> b mol
2Al + 6HCl ---->2 AlCl3 + 3H2↑↑
c mol-----------------------> 1,5c mol
Ta có:
56a + 52b + 27c = 2,7 (1)
a + b + 1,5c = 0,07 (2)
PTHH:
2Fe + 3Cl2 t0→t0→ 2FeCl3
a mol--------> a mol
2Cr + 3Cl2 t0→t0→2CrCl3
b mol--------> b mol
2Al + 3Cl2 to→2AlCl3
c mol-------> c mol
Ta lại có:
162,5a + 158,5b + 133,5c = 9,09 (3)
Từ (1),(2),(3) ta có pt:
56a+52b+27c=2,7
a+b+1,5c=0,07
162,5a+158,5b+133,5c=9,09
=> a = b = c = 0,02
mAl = 0,02 . 27 = 0,54(g)
Cho 5,68 gam P 2 O 5 vào cốc chứa 2,7 gam H 2 O thu được dung dịch axit photphoric H 3 P O 4 . Tính khối lượng axit tạo thành.
Đốt hoàn toàn 3,36 lít khí hiđro trong V (lít) khí oxi thu được m gam nước (Các khí ở đktc). Giá trị V, m lần lượt là: (Cho biết: H = 1, O = 16)
A. 1,68 lít; 2,7 gam
B. 3,36 lít; 2,7 gam
C. 3,36 lít; 3,6 gam
D. 1,68 lít; 3,6 gam
Xem chi tiết
2H2+O2-to->2H2O
0,15---0,075----0,15
nH2=3,36\22,4=0,15 mol
VO2=0,075.22,4=1,68l
mH2O=0,15.18=2,7g
==>A
Đúng 0
Bình luận (0)
Cho 2,7 gam nhôm vào 100 gam dd H2SO4 19,6%
a. Chất nào còn dư? Dư bao nhiêu
b, Tính nồng độ % các chất thu được sau pư
`PTHH: 2Al + 3H_2 SO_4 -> Al_2 (SO_4)_3 + 3H_2↑`
`a) n_[Al] = [ 2,7 ] / 27 = 0,1 (mol)`
`n_[H_2 SO_4] = [ [ 19,6 ] / 100 . 100 ] / 98 = 0,2 (mol)`
Ta có: `[ 0,1 ] / 2 < [0,2] / 3`
`=> H_2 SO_4` dư
Theo `PTHH` có: `n_[H_2 SO_\text{4(p/ứ)}] = 3 / 2 n_[Al] = 3 / 2 . 0,1 = 0,15 (mol)`
`=>m_[H_2 SO_\text{4(dư)}] = ( 0,2 - 0,15 ) . 98 = 4,9 (g)`
_____________________________________________________
`c)`Theo `PTHH` có: `n_[H_2] = 3 / 2 n_[Al] = 3 / 2 . 0,1 = 0,15 (mol)`
`-> m_\text{dd sau p/ứ} = 2,7 + 100 - 0,15 . 2 = 102,5 (g)`
`=> C%_[H_2 SO_\text{4(dư)}] = [ 4,9 ] / [102,5 ] . 100 ~~ 4,78 %`
Theo `PTHH` có: `n_[Al_2 (SO_4)_3] = 1 / 2 n_[Al] = 1 / 2 . 0,1 = 0,05 (mol)`
`=> C%_[Al_2 (SO_4)_3] = [ 0,05 . 342 ] / [ 102,5 ] . 100 ~~ 16,68%`
Đúng 3
Bình luận (0)
\(nAl=\dfrac{2,7}{27}=0,1\left(mol\right)\)
\(mH_2SO_4=\dfrac{100.19,6}{100}=19,6\left(g\right)\)
\(nH_2SO_4=\dfrac{19,6}{98}=0,2\left(mol\right)\)
\(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\)
2 3 1 3 (mol)
0,1 0,15 0,05 0,15 (mol)
LTL : \(\dfrac{0,1}{2}< \dfrac{0,2}{3}\)
=> Al đủ , H2SO4 dư
m H2SO4 ( dư ) = ( 0,2 - 0,15 ) . 98 = 4,9 (g)
\(mAl_2\left(SO_4\right)_3=0,05.342=17,1\left(g\right)\)
\(mH_2=0,15.2=0,3\left(g\right)\)
m dd = mAl + mddH2SO4 + mAl2(SO4)3 - mH2
m dd = 2,7 + 100 + 17,1 - 0,3 = 119,5 (g)
\(C\%_{ddH_2SO_4}=\dfrac{4,9.100}{119,5}=4,1\%\)
\(C\%_{Al_2\left(SO_4\right)_3}=\dfrac{17,1.100}{119,5}=14,3\%\)
\(C\%_{H_2}=\dfrac{0,3.100}{119,5}=0,25\%\)
Đúng 1
Bình luận (0)
Cho 2,7 gam nhôm (Al) tác dụng với khí oxi, tính khối lượng nhóm axit tạo thành
\(n_{Al}=\dfrac{2,7}{27}=0,1\left(mol\right)\\
pthh:4Al+3O_2\underrightarrow{t^o}2Al_2O_3\)
0,1 0,05
=> \(m_{Al_2O_3}=102.0,05=5,1\left(g\right)\)
Đúng 2
Bình luận (0)
\(n_{Al}=\dfrac{2,7}{27}=0,1\left(mol\right)\)
PTHH: 4Al + 3O2 --to--> 2Al2O3
0,1------------------>0,05
=> mAl2O3 = 0,05.102 = 5,1 (g)
Đúng 2
Bình luận (0)
Cho 2,7 gam Al vào dung dịch H2SO4 loãng chứ 19,6 gam H2SO4. Thể tích H2 (đktc) thoát ra là:
A.3,36 lít
B.4,48 lít
C.2,24 lít
D.1,12 lít
Xem thêm câu trả lời
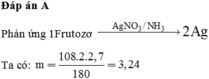
Cho 2,7 gam fructozơ tác dụng hoàn toàn với lượng dư dung dịch AgNO3 trong NH3 (đun nóng, thu được m gam Ag. Giá trị của m là A. 3,14. B. 2,16. C. 1,62. D. 6,48.
Đọc tiếp
Cho 2,7 gam fructozơ tác dụng hoàn toàn với lượng dư dung dịch AgNO3 trong NH3 (đun nóng, thu được m gam Ag. Giá trị của m là
A. 3,14.
B. 2,16.
C. 1,62.
D. 6,48.
Cho 2,7 gam Al tác dụng với 36,5 gam dd HCl 40% thu được 0,336 lít H2 ( ddktc). Tính hiệu suất pứ.
Mọi người giúp với ạ thanks nhiều
![]()
Theo gt ta có: $n_{Al}=0,1(mol);n_{HCl}=0,4(mol);n_{H_2}=0,015(mol)$
$2Al+6HCl\rightarrow 2AlCl_3+3H_2$
Ta có: $n_{Al/pu}=0,01(mol)$
Do đó $\%H=10\%$
Đúng 2
Bình luận (0)
Cho 2,7 gam Al và 5,76 gam Fe vào 180 ml dung dịch CuSO4 1M. Sau khi các phản ứng xảy ra hoàn toàn, thu được m gam kim loại. Giá trị của m là
A. 18,40.
B. 15,60.
C. 15,44.
D. 15,76.
Giải thích: Đáp án B
nAl = 0,1 mol
nFe = 18/175 mol
3nAl+2nFe > nCu2+ => KL dư, Cu2+ hết
BT e: 3nAl + 2nFe pư = 2nCu2+ => 0,1.3 + 2x = 2.0,18 => x = 0,03 mol
mKL = mCu + mFe dư = 0,18.64 + 5,76 – 0,03.56 = 15,6 gam
Đúng 0
Bình luận (0)