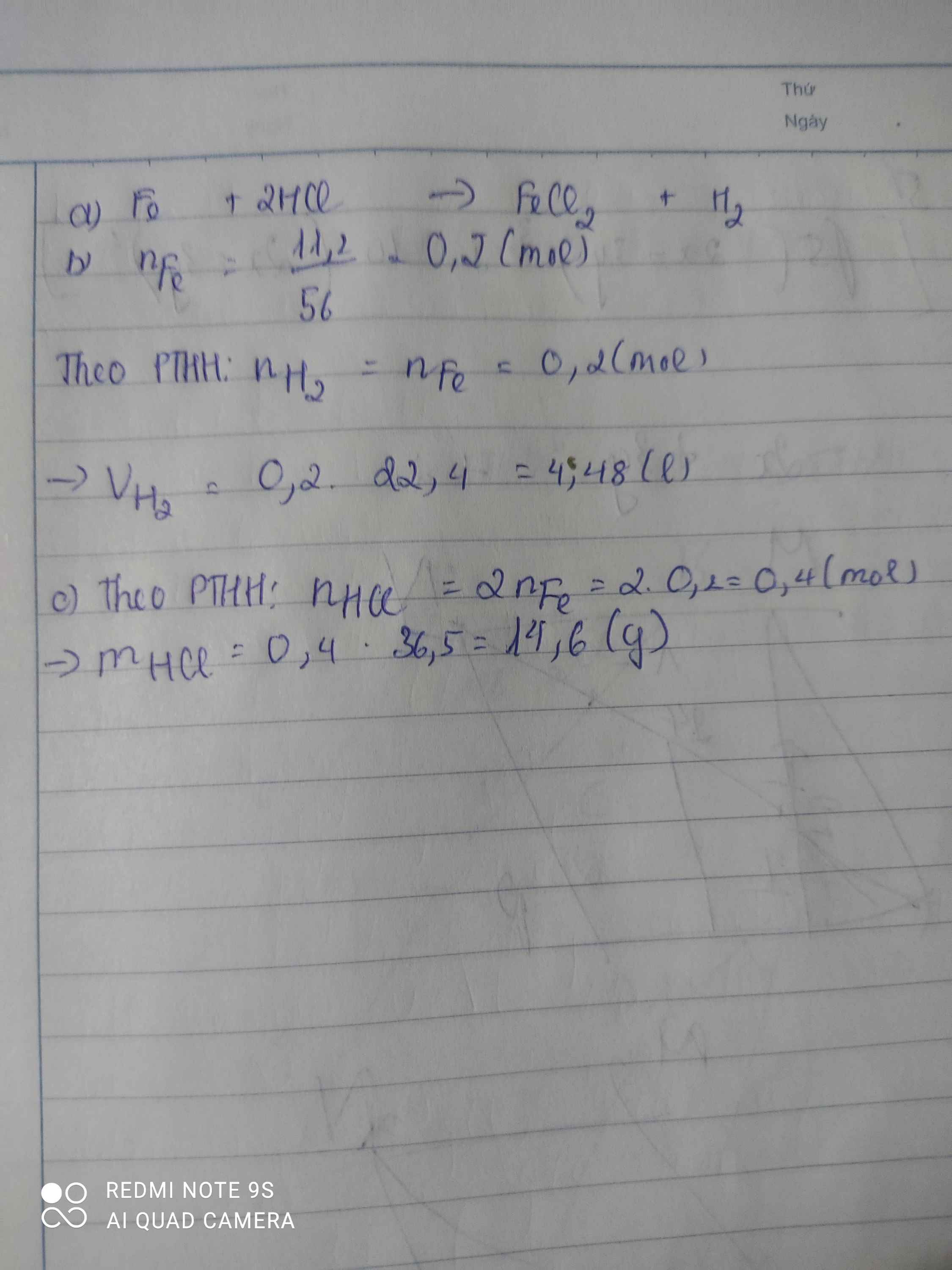hoà tan hoàn toàn 5 6g sắt vào axit clohidric .Ta thu được sắt(2) clorua và 0,2g khí hidro .tính khối lượng của sắt (2) clorua thu được

Những câu hỏi liên quan
Bài 1. Hòa tan hoàn toàn 11,2 gam sắt vào axit clohidric (HCl) thu được sắt (II) clorua (FeCl2) và khí hidro.
a. Viết phương trình há học xảy ra.
b. Tính thể tích khí hidro sinh ra ở đktc.
c. Tính khối lượng axit clohidric đã dùng.
a,\(n_{Fe}=\dfrac{11,2}{56}=0,2\left(mol\right)\)
PTHH: Fe + 2HCl → FeCl2 + H2
Mol: 0,2 0,4 0,2
b, \(V_{H_2}=0,2.22,4=4,48\left(l\right)\)
c, \(m_{HCl}=0,4.36,5=14,6\left(g\right)\)
Đúng 3
Bình luận (0)
Bài 1. Hòa tan hoàn toàn 11,2 gam sắt vào axit clohidric (HCl) thu được sắt (II) clorua (FeCl2) và khí hidro.
a. Viết phương trình há học xảy ra.
b. Tính thể tích khí hidro sinh ra ở đktc.
c. Tính khối lượng axit clohidric đã dùng.
\(n_{Fe}=\dfrac{11.2}{56}=0.2\left(mol\right)\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
\(0.2.......0.4....................0.2\)
\(V_{H_2}=0.2\cdot22.4=4.48\left(l\right)\)
\(m_{HCl}=0.4\cdot36.5=14.6\left(g\right)\)
Đúng 3
Bình luận (0)
PTHH : \(Fe+2HCl-->FeCl_2+H_2\uparrow\) (1)
\(n_{Fe}=\dfrac{m}{M}=\dfrac{11.2}{56}=0.2\left(mol\right)\)
Từ (1) => \(n_{Fe}=n_{H_2}=0.2\left(mol\right)\)
=> \(V_{H2\left(đktc\right)}=n.22,4=0,2.22,4=4,48\left(l\right)\)
Từ (1) => \(2n_{Fe}=n_{HCl}=0.4\left(mol\right)\)
=> \(m_{HCl}=n.M=0,4.\left(1+35.5\right)=14.6\left(g\right)\)
Đúng 3
Bình luận (0)
Hòa tan hoàn toàn 11,2 gam sắt (Fe) bằng dung dịch axit clohidric (HCl) vừa đủ, thu được muối sắt clorua (FeCl2) và khí hidro.
a. Viết phương trình hóa học.
b. Tính V khí hidro thu được (đktc) và khối lượng muối FeCl2.
\(n_{Fe}=\dfrac{11,2}{56}=0,2(mol)\\ a,Fe+2HCl\to FeCl_2+H_2\\ b,n_{FeCl_2}=n_{H_2}=n_{Fe}=0,2(mol)\\ \Rightarrow V_{H_2}=0,2.22,4=4,48(l)\\ m_{FeCl_2}=0,2.127=25,4(g)\)
Đúng 5
Bình luận (0)
\(n_{Fe}=\dfrac{11.2}{56}=0.2\left(mol\right)\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
\(0.2....................0.2........0.2\)
\(V_{H_2}=0.2\cdot22.4=4.48\left(l\right)\)
\(m_{FeCl_2}=0.2\cdot127=25.4\left(g\right)\)
Đúng 5
Bình luận (0)
hòa tan 11.2g sắt vào dung dịch axit clohidric thì thu đc sắt (II) clorua và khí hidroa) lập PTHH của phản ứng trên b) tính khối lượn axit clohidric đã dùng c) tính khối lượn sắt (II) clorua thu đcd) tính thể tích khí hidro sinh rae) nếu đem toàn bộ lượng khí hidro sinh ra ở trên cho qua 24g đồng (II) oxit thì sẽ thu đc tối đa là bao nhiêu gam đồng
Đọc tiếp
hòa tan 11.2g sắt vào dung dịch axit clohidric thì thu đc sắt (II) clorua và khí hidro
a) lập PTHH của phản ứng trên
b) tính khối lượn axit clohidric đã dùng
c) tính khối lượn sắt (II) clorua thu đc
d) tính thể tích khí hidro sinh ra
e) nếu đem toàn bộ lượng khí hidro sinh ra ở trên cho qua 24g đồng (II) oxit thì sẽ thu đc tối đa là bao nhiêu gam đồng
a) \(Fe+2HCl\rightarrow FeCl_2+H_2\)
b) \(n_{Fe}=\dfrac{11,2}{56}=0,2\left(mol\right)\)
Theo PTHH: \(n_{HCl}=2n_{Fe}=0,4\left(mol\right)\)
\(\Rightarrow m_{HCl}=0,4.36,5=14,6\left(g\right)\)
c) Theo PTHH: \(n_{FeCl_2}=n_{H_2}=n_{Fe}=0,2\left(mol\right)\)
\(\Rightarrow m_{FeCl_2}=0,2.127=25,4\left(g\right)\)
d) \(V_{H_2}=0,2.22,4=4,48\left(l\right)\)
e) \(n_{CuO}=\dfrac{24}{80}=0,3\left(mol\right)\)
PTHH: \(CuO+H_2\xrightarrow[]{t^o}Cu+H_2O\)
Xét tỉ lệ: \(\dfrac{0,3}{1}>\dfrac{0,2}{1}\Rightarrow CuO\) dư
Theo PTHH: \(n_{Cu}=n_{H_2}=0,2\left(mol\right)\)
\(\Rightarrow m_{Cu}=0,2.64=12,8\left(g\right)\)
Đúng 2
Bình luận (0)
Câu 9. (2,0 điểm) Hòa tan hoàn toàn 11,2 gam sắt (Fe) vào dung dịch axit clohidric (HCl) thu được muối sắt (II) clorua (FeCl2) và khí hidro (H2)
a) Viết phương trình hoá học của phản ứng.
b) Tính khối lượng của FeCl2 tạo thành sau phản úng?
a)
$Fe + 2HCl \to FeCl_2 + H_2$
b)
Theo PTHH :
$n_{FeCl_2} = n_{Fe} = \dfrac{11,2}{56} = 0,2(mol)$
$m_{FeCl_2} = 0,2.127 = 25,4(gam)$
Đúng 0
Bình luận (0)
cho 5 6g fe tác dụng với axit clohidric(hcl) thu được sắt(II) clorua (fecl2) và khí hidro
a) tính khối lượng hcl đã dùng
b) tính thể tích hidro thu được ở đctc
\(a,n_{Fe}=\dfrac{5,6}{56}=0,1\left(mol\right)\\ Fe+2HCl\rightarrow FeCl_2+H_2\\ n_{HCl}=2.n_{Fe}=2.0,1=0,2\left(mol\right)\\ m_{HCl}=0,2.36,5=7,3\left(g\right)\\ b,n_{H_2}=n_{Fe}=0,1\left(mol\right)\\ V_{H_2\left(đktc\right)}=0,1.22,4=2,24\left(l\right)\)
Đúng 3
Bình luận (0)
Hòa tan hoàn toàn 5,6g sắt vào 200ml dung dịch axit clohidric (HCl) thu được sắt (II) clorua (FeCl2) và khí hidro.
a) Tính thể tích khí H2 sinh ra ở đktc
b) Tính khối lượng muối sinh ra
c) Tính nồng độ mol của dung dịch axit clohidric cần dùng.
\(a) Fe + 2HCl \to FeCl_2 + H_2\\ n_{FeCl_2} = n_{H_2} = n_{Fe} = \dfrac{5,6}{56} = 0,1(mol)\\ V_{H_2} = 0,1.22,4 = 2,24(lít)\\ b)m_{FeCl_2} = 0,1.127 = 12,7(gam)\\ c) n_{HCl} =2 n_{Fe} = 0,2(mol)\\ C_{M_{HCl}} = \dfrac{0,2}{0,2} = 1M\)
Đúng 1
Bình luận (0)
\(n_{Fe}=\dfrac{5.6}{56}=0.1\left(mol\right)\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
\(0.1......0.2..........0.1..........0.1\)
\(V_{H_2}=0.1\cdot22.4=2.24\left(l\right)\)
\(m_{FeCl_2}=0.1\cdot127=12.7\left(g\right)\)
\(C_{M_{HCl}}=\dfrac{0.2}{0.2}=1\left(M\right)\)
Đúng 2
Bình luận (1)
pls giải giúp vs ạ!!
B1: cho các chất sau: CuSO4, NaPO4, CaO. Gọi tên phân loại
B2: Điều chế khí hidro người ta tiến hành hòa tan hoàn toàn 9,75g kẽm bằng lượng vừa đủ 300ml dd oxit clohidric
1) Viết PTHH của pư
2) Tính V khí hidro thu được (đktc)
3) Tính Cm của dd axit clohidric đã dùng
B3: Cho sắt vào dd Axit Clohidric thu được muối sắt (II) clorua và giải phóng 0,448l hidro ở đktc
a) Nêu hiện tượng và viết PT
b) Tính khối lượng sắt pư
c) Nếu dùng lượng khí hidro thu được ở trên là 0,448 đem...
Đọc tiếp
pls giải giúp vs ạ!!
B1: cho các chất sau: CuSO4, NaPO4, CaO. Gọi tên phân loại
B2: Điều chế khí hidro người ta tiến hành hòa tan hoàn toàn 9,75g kẽm bằng lượng vừa đủ 300ml dd oxit clohidric
1) Viết PTHH của pư
2) Tính V khí hidro thu được (đktc)
3) Tính Cm của dd axit clohidric đã dùng
B3: Cho sắt vào dd Axit Clohidric thu được muối sắt (II) clorua và giải phóng 0,448l hidro ở đktc
a) Nêu hiện tượng và viết PT
b) Tính khối lượng sắt pư
c) Nếu dùng lượng khí hidro thu được ở trên là 0,448 đem khử đồng(II) oxit ở nhiệt độ cao thì thu được bao nhiêu gam đồng?
B4: Hòa tan 8,4g hỗn hợp hai kim loại Mg và Fe vào 400ml dd HCl nồng đồ 2M. CMR hỗn hợp kim loại tan hết
Hòa tan hoàn toàn 11,2 gam sắt trong 300 gam dung dịch axit clohidric HCL (vừa đủ), thu được muối sắt (II) clorua \(FeCl_2\) và khí hidro.
a. Viết phương trình hóa học.
b. Tính khối lượng muối tạo thành.
c. Tính thể tích hidro sinh ra (đktc).
d.Tính nồng độ phần trăm của dung dịch axit đã dùng.
\(a) Fe + 2HCl \to FeCl_2 + H_2\\ b) n_{FeCl_2} = n_{Fe} =\dfrac{11,2}{56} = 0,2(mol)\\ m_{FeCl_2} = 0,2.127 = 25,4(gam)\\ c) n_{H_2} = n_{Fe} = 0,2(mol)\Rightarrow V_{H_2} = 0,2.22,4 = 4,48(lít)\\ d) n_{HCl} = 2n_{Fe} = 0,4(mol)\\ C\%_{HCl} = \dfrac{0,4.36,5}{300}.100\% = 4,867\%\)
Đúng 2
Bình luận (0)
Hòa tan hoàn toàn 5,6g sắt vào dung dịch Axit Clohidric thu được Sắt 2 Clorua và V(lít) khí H2 đo ở dktc a) Viết phản ứng hóa học xảy ra b)Tính kg Sắt thu được...
Đọc tiếp
Hòa tan hoàn toàn 5,6g sắt vào dung dịch Axit Clohidric thu được Sắt 2 Clorua và V(lít) khí H2 đo ở dktc a) Viết phản ứng hóa học xảy ra b)Tính kg Sắt thu được c) Tính V(lit) H2 thu được ở dktc
a) nFe= \(\frac{m_{Fe}}{M_{Fe}}=\frac{5,6}{56}=0,1\left(mol\right)\)
PTHH: Fe+ 2HCl -> FeCl2 + H2\(\uparrow\)
Theo PTHH: 1:2:1:1 (mol)
Theo đề bài: 0,1:0,2:0,1:0,1 (mol)
b)Theo PTHH và đề bài, ta có:
\(n_{FeCl_2}=n_{Fe}=0,1\left(mol\right)\)
Khối lượng FeCl2 thu được:
\(m_{FeCl_2}=n_{FeCl_2}.M_{FeCl_2}=0,1.127=12,7\left(g\right)\)
Mà, ta lại có: 12,7 g= 0,0127 (kg)
c) Theo PTHH và đề bài, ta có:
\(n_{H_2}=n_{Fe}=0,1\left(mol\right)\)
Thể tích khí H2 thu được (đktc) là:
\(V_{H_2\left(đktc\right)}=n_{H_2}.22,4=0,1.22,4=2,24\left(l\right)\)
Đúng 0
Bình luận (0)