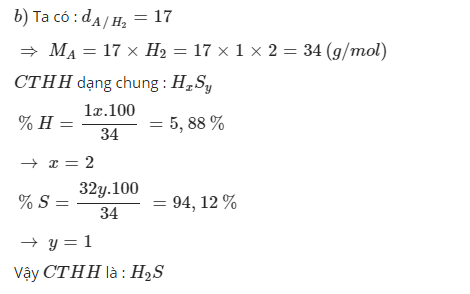hợp chất f có 5,88% là h,còn lại là s.biết tỉ khối khí của f so với oxi là 17.

Những câu hỏi liên quan
Lập CTHH các chất sau:A) Al và OB) Zn và ClC)H và S(II)D) Fe(III) và nhóm OHE) hợp chất khí A có thành phần trăm các nguyên tô (theo hối lượng) 5,88% H, 94,12%S.biết tỉ khối của khí A so với Hidro là 17.F)hợp chất A có thành phần % các nguyên tố: 2,04% H, 32,65% S và còn lại là oxi.G) hợp chất A có thành phần % các nguyên tố: 40% S còn lại là oxi. Biết khối lượng mol của A là 80g
Đọc tiếp
Lập CTHH các chất sau:
A) Al và O
B) Zn và Cl
C)H và S(II)
D) Fe(III) và nhóm OH
E) hợp chất khí A có thành phần trăm các nguyên tô (theo hối lượng) 5,88% H, 94,12%S.biết tỉ khối của khí A so với Hidro là 17.
F)hợp chất A có thành phần % các nguyên tố: 2,04% H, 32,65% S và còn lại là oxi.
G) hợp chất A có thành phần % các nguyên tố: 40% S còn lại là oxi. Biết khối lượng mol của A là 80g
a)\(Al_2O_3\)
b)\(ZnCl_2\)
c)\(H_2S\)
d)\(Fe\left(OH\right)_3\)
Đúng 0
Bình luận (0)
a) Al2O3
B) ZnCl2
C) H2S
D) Fe(OH)3
e) H2S
F) H2SO4
G) SO3
Đúng 0
Bình luận (0)
hợp chất chứa 5,88% là H còn lại là S. Tỉ khối của hợp chất so với khí H2 là 17 . Tìm CTHH của hợp chất Giúp mình với ạ
\(M_{hc}=17.M_{H_2}=17.2=34\left(đ.v.C\right)\\ Đặt:H_xS_y\left(x,y:nguyên,dương\right)\\ Ta.có:x=\dfrac{5,88\%.34}{1}=2\\ y=\dfrac{34-2.1}{32}=1\\ \Rightarrow CTHH:H_2S\)
Đúng 1
Bình luận (0)
Xác định công thức của các chất sau
a)E có 24,68%K ;34,81%Mn ;40,51%O .E nặng hơn NaNO3 1,86 lần .
b)F chứa 5,88% về khối lượng là H còn lại là của S. F nặng hơn khí hidro 17 lần
a, Hợp chất A được tạo bởi nguyên tố lưu huỳnh và nguyên tố oxi. Tỉ khối của A so với Hidro là 32. Tìm công thức hóa học của A biết trong A, lưu huỳnh chiếm 50%.
b, Chất khí A có thành phần nguyên tố là: 5,88%H; 94,12% S. Khí A nặng hơn khí hidro 17 lần. Công thức hóa học của hợp chất đó là ?
a) MA = 32.2 = 64(g/mol)
\(m_S=\dfrac{64.50}{100}=32\left(g\right)=>n_S=\dfrac{32}{32}=1\left(mol\right)\)
\(m_O=64-32=32\left(g\right)=>n_O=\dfrac{32}{16}=2\left(mol\right)\)
=> CTHH: SO2
b) MA = 2.17 = 34 (g/mol)
\(m_H=\dfrac{34.5,88}{100}=2\left(g\right)=>n_H=\dfrac{2}{1}=2\left(mol\right)\)
\(m_S=34-2=32\left(g\right)=>n_S=\dfrac{32}{32}=1\left(mol\right)\)
=> CTHH: H2S
Đúng 3
Bình luận (0)
Hợp chất khí A có tỉ khối so với khí hđro bằng 17, thành phần các nguyên tố của khí A là 5,88% H và 94,12% S.
Xác định CTHH của A?
\(d_{\dfrac{A}{H_2}}=17\\ \Rightarrow M_A=17.2=34\left(\dfrac{g}{mol}\right)\)
\(m_H=\dfrac{5,88.34}{100}=2g\\ m_S=\dfrac{94,12.34}{100}=32g\)
\(n_H=\dfrac{2}{1}=2mol\\ n_S=\dfrac{32}{32}=1mol\\ \Rightarrow CTHH:H_2S\)
Đúng 2
Bình luận (1)
Một hợp chất khí X có thành phần trăm theo khối lượng là: 94,12%S và 5,88%H. Hãy lập công thức hóa học của hợp chất, biết tỉ khối của khí X đối với hidro là 17.
Giúp mình với ạ mình xin mọi người
MX = 17.2 = 34 (g/mol)
\(m_S=\dfrac{94,12.34}{100}=32\left(g\right)=>n_S=\dfrac{32}{32}=1\left(mol\right)\)
\(m_H=\dfrac{5,88.34}{100}=2\left(g\right)=>n_H=\dfrac{2}{1}=2\left(mol\right)\)
=> CTHH: H2S
Đúng 1
Bình luận (2)
BT1: Một hợp chất X có thành phần % theo khối lượng là: 5,88%H; 94,12%S. Hãy xác định công thức hóa học của hợp chất, biết rằng hợp chất này có tỉ khối so với Hiđro là 17
PLEASE HELP ME
M(X)= 17.2= 34(g/mol)
Gọi CTTQ của X là HxSy (x,y: nguyên, dương)
mH= 34.5,88% \(\approx\) 2(g) -> x=nH=2/1=2
mS=34-2=32(g) ->y=nS=32/32=1
=> Với x=2;y=1 -> X là H2S
Đúng 2
Bình luận (0)
Hãy tìm CTHH của hợp chất A có chứa 5.88%H và 94.12%S.Biết khí A có tỉ khối với không khí là 1.172
Vậy: CT dạng tối giản của hợp chất A là H2S.
CT thực nghiệm là (H2S)a (a: nguyên, dương)
<=>(2.1+32)a= 34=> a=1
=> CTHH của hợp chất A là H2S (axit sunfurhiđric).
Đúng 0
Bình luận (0)
Hãy tìm CTHH của hợp chất A có chứa 5.88%H và 94.12%S.Biết khí A có tỉ khối với không khí là 1.172
Vậy: CT dạng tối giản của hợp chất A là H2S.
CT thực nghiệm là (H2S)a (a: nguyên, dương)
<=>(2.1+32)a= 34=> a=1
=> CTHH của hợp chất A là H2S (axit sunfurhiđric).
Đúng 0
Bình luận (0)
a) Hợp chất X có công thức : R2(SO4)3 . Biết phân tử khối của X là 342 Đvc . Tính nguyên tử cua R và cho biết R là nguyên tố nào ?
b) Hãy tìm công thức hoá học của A biết rằng :
- Tỉ khối của khí A đối với khí B là 2,125 và tỉ khối của khí B đối với khí oxi là 0,5
- Thành phần theo khối lượng của A là 5,88% H và 94,12 % S
a) Có 2R+(96x3)=342
Suy ra: R=27 là nhôm(Al)
b) MB=32x0,5=16
Suy ra: MA=16x2,125=34
Ta có : HuSv
5,88%=100u/34 =>u=2
94,12%=32 x 100 x v/34 => v=1
Vậy công thức hoá học của A là: H2S
Chúc bạn học tốt!
Đúng 1
Bình luận (0)