Để đốt cháy hoàn toàn 24 lit CH4 cần dùng bao nhiêu lit không khí? Biết Oxi chiếm 20% thể tích không khí và các khí đo ở cùng điều kiện nhiệt độ, áp suất. *
A. 48 lit.
B. 24 lit
C. 240 lit.
D. 120 lit
Đốt cháy hoàn toàn một thể tích khí metan cần dùng 336 ml không khí (a) Tính thể tích khí metan đã cháy (b) Tính thể tích khí CO2 tạo thành. Biết oxi chiếm 1/5 thể tích không khí. Các khí đo ở cùng điều kiện nhiệt độ và áp suất
\(V_{O_2}=\dfrac{336}{5}=67,2\left(ml\right)=0,0672\left(l\right)\\ n_{O_2}=\dfrac{0,0672}{22,4}=0,003\left(mol\right)\\ CH_4+2O_2\rightarrow\left(t^o\right)CO_2+2H_2O\\ n_{CO_2}=n_{CH_4}=\dfrac{0,003}{2}=0,0015\left(mol\right)\\ a,V_{CH_4\left(đktc\right)}=0,0015.22,4=0,0336\left(l\right)\\ b,V_{CO_2\left(đktc\right)}=V_{CH_4\left(đktc\right)}=0,0336\left(l\right)\)
Đốt cháy hoàn toàn 11,2 lit khí etilen ( C2H4 ) tạo ra sản phẩm CO2 và H2O
a) tính thể tích khí oxi cần dùng ở phản ứng trên
b) tính thể tích không khí cần dùng, biết khí oxi chiếm ⅕ thể tích không khí. Biết thể tích khi ở điều kiện tiêu chuẩn
a, \(C_2H_4+3O_2\underrightarrow{t^o}2CO_2+2H_2O\)
Ta có: \(n_{C_2H_4}=\dfrac{11,2}{22,4}=0,5\left(mol\right)\)
Theo PT: \(n_{O_2}=3n_{C_2H_4}=1,5\left(mol\right)\Rightarrow V_{O_2}=1,5.22,4=33,6\left(l\right)\)
b, \(V_{kk}=\dfrac{V_{O_2}}{20\%}=168\left(l\right)\)
Đốt cháy hoàn toàn 11,2 lit khí etilen ( C2H4 ) tạo ra sản phẩm CO2 và H2O
a) tính thể tích khí oxi cần dùng ở phản ứng trên
b) tính thể tích không khí cần dùng, biết khí oxi chiếm s thể tích không khí. Biết thể tích khi ở điều kiện tiêu chuẩn
PTHH: \(C_2H_4+3O_2\underrightarrow{t^o}2CO_2+2H_2O\)
\(n_{C_2H_4}=\dfrac{11,2}{22,4}=0,5\left(mol\right)\)
Theo PTHH: \(n_{O_2}=3.n_{C_2H_4}=3.0,5=1,5\left(mol\right)\)
=> \(V_{O_2\left(đktc\right)}=1,5.22,4=33,6\left(l\right)\)
câu b oxi chiếm bao nhiêu của kk vậy bạn
Đốt cháy hoàn toàn 3,36 lit khí metan CH4 trong không khí. biết õi chiếm 20% thể tích không khí . Thể tích không khí cần dùng ở đktc là :
A. 2,24 lít
B. 6,72 lít C.
11,2 lít
D. 22,4lít
\(n_{CH_4}=\dfrac{3,36}{22,4}=0,15mol\)
\(CH_4+2O_2\underrightarrow{t^o}CO_2+2H_2O\)
0,15 0,3
\(V_{O_2}=0,3\cdot22,4=6,72l\)
\(\Rightarrow V_{kk}=5V_{O_2}=5\cdot6,72=33,6l\)
Không có đáp án đúng!
Cần bao nhiêu lít khí nitơ và khí hiđro để điều chế được 67,2 lit khí amoniac? Biết rằng thể tích của các khí đề được đo ở cùng điều kiện nhiệt độ, áp suất và hiệu suất của phản ứng là 25%?
Ta thấy tỉ lệ về thể tích cùng là tỉ lệ về số mol:
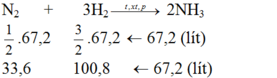
Tỉ lệ số mol cũng chính là tỉ lệ thể tích
Theo pt:
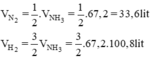
Do hiệu suất của phản ứng là 25% nên thể tích của nitơ và hiđro cần lấy là:
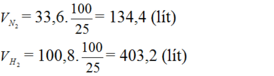
Đốt cháy hoàn toàn 4,48 lít khí CH4 ngoài không khí a) Tính thể tích khí Oxi cần dùng trong phản ứng b) Tính thể tích không khí cần dùng, biết Oxi chiếm 1/5 thể tích không khí ( các chất khí đo ở điều kiện tiêu chuẩn)
a. \(n_{CH_4}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
PTHH : CH4 + 2O2 -> CO2 + 2H2O
0,2 0,4 ( mol )
\(V_{O_2}=0,4.22,4=8,96\left(l\right)\)
b. \(V_{kk}=8,96.5=44,8\left(l\right)\)
nCH4 = 6.72: 22,4 = 0.3 (mol)
a)
PTHH CH4 + 2O2 → CO2 + 2H2O
1 2 1 2 (mol)
0,15 0,3 0,15 0,3
b)
VO2 = n.22,4 = 0,6 . 22,4 = 13.44 (l)
⇒V kk = V O2 . 5 = 13.44 . 5 = 67.2 (l)
PT: \(CH_4+2O_2\underrightarrow{t^o}CO_2+2H_2O\)
Ta có: \(n_{CH_4}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
Theo PT: \(\left\{{}\begin{matrix}n_{CO_2}=n_{CH_4}=0,3\left(mol\right)\\n_{O_2}=n_{H_2O}=2n_{CH_4}=0,6\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow m_{CO_2}=0,3.44=13,2\left(g\right)\)
\(m_{H_2O}=0,6.18=10,8\left(g\right)\)
\(V_{O_2}=0,6.22,4=13,44\left(l\right)\Rightarrow V_{kk}=13,44.5=67,2\left(l\right)\)
Bạn tham khảo nhé!
Đốt cháy hoàn toàn 5lít khí hidro trong không khí sinh ra hơi nước .tính thể tích khí oxi và thể tích không khí cần dùng biết rằng các thể tích khí đo trog cùng điều khiện nhiệt độ và áp suất
Ta có nH=5:22,4=\(\frac{25}{112}\) mol
pthh:4H+O2\(\rightarrow\)2H2O
\(\Rightarrow\)nO2= \(\frac{1}{4}.\frac{25}{112}=\frac{25}{448}\) MOL
VO2=\(\frac{25}{448}.22,4=1,25\) lít
vì VO2=\(\frac{1}{5}\)Vkk\(\Rightarrow\) 1,25.5=6,25(lít)
vậy Vkk=6,25 lít
chúc bạn học tốt like mình nha![]()
Các khí đo ở cùng điều kiện nhiệt độ , áp suất thì tỉ lệ về thể tích cũng là tỉ lệ về số mol
C8H18 + 25/2O2 --> 8CO2 + 9H2O
Theo pt : 1 25/2 8 9 (lít)
Theo đề bài 8 <------100
Theo đề bài 240 ------> 3000
Vậy thể tích khí C8H18 cháy trong 500l không khí tức 100 lít Oxi là 8 lít,
Thể tích oxi cần dùng để đốt cháy hết 240 lít C8H18 là 3000 lít