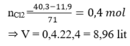Đốt cháy hoàn toàn một sợi dây bằng aluminium (Al) trong bình chứa khí chlorine (Cl2), sau phản ứng thu được 26,7 gam aluminium chloride (AlC/g). Tính thể tích khí chlorine đã tham gia cho phản ứng trên trong điều kiện chuẩn. Al + Cl2 →> AlCI3

Những câu hỏi liên quan
Đốt cháy 9,45 gam aluminium trong bình chứa khí chlorine người ta thu được aluminium chlorine
a) Viết PTHH
b) Tính thể tích khí chlorine ở điều kiện chuẩn
c) Tính khối lượng AlCl3 thu được
\(n_{Al}=\dfrac{9,45}{27}=0,35\left(mol\right)\\ a,PTHH:2Al+3Cl_2\rightarrow\left(t^o\right)2AlCl_3\\ b,n_{Cl_2}=\dfrac{3}{2}.0,35=0,525\left(mol\right)\\ V_{Cl_2\left(đkc\right)}=0,525.24,79=13,01475\left(l\right)\\ c,n_{AlCl_3}=n_{Al}=0,35\left(mol\right)\\ m_{AlCl_3}=0,35.133,5=46,725\left(g\right)\)
Đúng 2
Bình luận (1)
Đốt cháy hết 0,54 gam Al trong không khí thu được aluminium oxide Lập phương trình hóa học của phản ứng rồi tính: a. Khối lượng aluminium oxide tạo ra. b. Thể tích khí oxygen tham gia phản ứng ở điều kiện chuẩn
\(n_{Al}=\dfrac{0,54}{27}=0,02\left(mol\right)\)
Pt : \(4Al+3O_2\xrightarrow[]{t^o}2Al_2O_3\)
0,02-->0,015-->0,01
a) \(m_{Al2O3}=0,01.102=1,02\left(g\right)\)
b) \(V_{O2\left(dktc\right)}=0,015.24,79=0,37185\left(l\right)\)
Đúng 2
Bình luận (1)
`#\text{id07 - 25th8}.`
a.
Số mol của Al có trong pứ là:
\(n_{Al}=\dfrac{m_{Al}}{M_{Al}}=\dfrac{0,54}{27}=0,02\left(\text{mol}\right)\)
PTHH: \(\text{4Al + 3O}_2\text{ }\text{ }\underrightarrow{t^0}\text{ }\text{ 2Al}_2\text{O}_3\)
Theo pt: 4 : 2 (mol)
`=> 0,02` : `0,01` (mol)
`=>` n của Al2O3 thu được sau pứ là `0,01` mol
m của Al2O3 thu được sau pứ là:
\(m_{Al_2O_3}=n_{Al_2O_3}\cdot M_{Al_2O_3}=0,01\cdot\left(27\cdot2+16\cdot3\right)=0,01\cdot102=1,02\left(g\right)\)
b.
Theo pt: 4 : 3 (mol)
`=>` 0,02 : 0,015 (mol)
`=>` n của O2 có trong pứ là `0,015` mol
V của khí O2 tham gia pứ ở đkc là:
\(V_{O_2}=n_{O_2}\cdot24,79=0,015\cdot24,79=0,37185\left(l\right).\)
Vậy:
a. m Al2O3 `=` `1,02` g
b. V O2 `= 0,37185` l.
Đúng 2
Bình luận (2)
Đốt cháy hết 5,4 gam aluminium (Al) trong không khí thu được aluminium oxide (Al2O3).
a) Tính khối lượng aluminium oxide thu được.
b) Tính thế tích khí oxygen tham gia phản ứng ở điều kiện chuẩn.
Đọc tiếp
Đốt cháy hết 5,4 gam aluminium (Al) trong không khí thu được aluminium oxide (Al2O3).
a) Tính khối lượng aluminium oxide thu được.
b) Tính thế tích khí oxygen tham gia phản ứng ở điều kiện chuẩn.
\(a)n_{Al}=\dfrac{5,4}{27}=0,2mol\\ 4Al+3O_2\xrightarrow[]{t^0}2Al_2O_3\\ n_{Al_2O_3}=\dfrac{0,2.2}{4}=0,1mol\\ m_{Al_2O_3}=0,1.102=10,2g\\ b)n_{H_2}=\dfrac{0,2.3}{4}=0,15mol\\ V_{O_2}=0,15.24,79=3,7185l\)
Đúng 1
Bình luận (0)
Đốt cháy hết 0,54 gam Al trong không khí thu được aluminium oxide theo sơ đồ phản ứng:
Al + O2 → Al2O3
Lập phương trình hoá học của phản ứng rồi tính:
a) Khối lượng aluminium oxide tạo ra.
b) Thể tích khí oxygen tham gia phản ứng ở điều kiện chuẩn.
Phương trình hoá học: 4Al + 3O2 → 2Al2O3.
Số mol Al tham gia phản ứng:
n Al = mAl : M Al = 0,54 : 27 = 0,02 mol
a) Từ phương trình hóa học ta có:
n Al2O3 = ½ n Al = 0,02 : 2 = 0,01 mol
n Al2O3 = 0,01 x 102 = 10,2 gam
b) theo phương trình hóa học ta có:
n O2 = ¾ n Al = ¾ x 0,02 = 0,015 mol
V O2 (đkc) = 0,015 x 24,79 = 0,37185 (lít)
Đúng 1
Bình luận (0)
\(PTHH:4Al+3O_2\left(t^o\right)\rightarrow2Al_2O_3\\ n_{Al}=\dfrac{0,54}{27}=0,02\left(mol\right)\Rightarrow n_{Al}=\dfrac{2}{4}.0,02=0,01\left(mol\right);n_{O_2}=\dfrac{3}{4}.0,02=0,15\left(mol\right)\\ a,m_{Al_2O_3}=0,01.27=0,27\left(g\right)\\ b,V_{O_2\left(đkc\right)}=0,15.24,79=3,7185\left(l\right)\)
Đúng 0
Bình luận (0)
Đốt cháy 11,9 gam hỗn hợp gồm Zn, Al trong khí
Cl
2
dư. Sau khi các phản ứng xảy ra hoàn toàn, thu được 40,3 gam hỗn hợp muối. Thể tích khí
Cl
2
(đktc) đã tham gia phản ứng là A, 8,96 lít B. 6,72 lít C. 17,92 lít D. 11,20 lít
Đọc tiếp
Đốt cháy 11,9 gam hỗn hợp gồm Zn, Al trong khí Cl 2 dư. Sau khi các phản ứng xảy ra hoàn toàn, thu được 40,3 gam hỗn hợp muối. Thể tích khí Cl 2 (đktc) đã tham gia phản ứng là
A, 8,96 lít
B. 6,72 lít
C. 17,92 lít
D. 11,20 lít
đốt cháy 0,54 gam aluminium trong khí oxygen, phản ứng hoàn toàn thu được bao nhiêu gam aluminium oxide ? có bao nhiêu lít oxygen điều kiện tiêu chuẩn tham gia phản ứng ? Giúp m với ạ :((
\(4Al+3O_2\underrightarrow{^{to}}2Al_2O_3\\ n_{Al}=\dfrac{0,54}{27}=0,02\left(mol\right)\\ \Rightarrow n_{Al_2O_3}=\dfrac{2}{4}.0,02=0,01\left(mol\right)\\ n_{O_2}=\dfrac{3}{4}.0,02=0,015\left(mol\right)\\ m_{Al_2O_3}=102.0,01=1,02\left(g\right)\\ V_{O_2\left(đktc\right)}=0,015.22,4=0,336\left(l\right)\)
Đúng 1
Bình luận (0)
Đốt cháy mg kim loại Aluminium (Al) trong không khí thu được 10g hợp chất Aluminium oxide (AL2O3). Biết rằng khối lượng Aluminium (Al) tham gia bằng 1,5 lần khối lượng của oxygen (không khí) tham gia phản ứng.
a. Viết phản ứng hoá học.
b. Tính khối lượng của Al và oxygen đã phản ứng.
a, \(4Al+3O_2\underrightarrow{t^o}2Al_2O_3\)
b, Gọi: mO2 = x (g) ⇒ mAl = 1,5x (g)
Theo ĐLBT KL, có: mAl + mO2 = mAl2O3
⇒ 1,5x + x = 10
⇒ x = 4 (g) = mO2
mAl = 1,5.4 = 6 (g)
Đúng 1
Bình luận (0)
Bài 1. Cho 13g Zinc tác dụng với dd H,SO4. Tính:
a, Khối lượng acid đã tham gia phản ứng?
b, Khối lượng muối ZnSO, tạo thành?
C, Thể tích khí hidro thu được sau phản ứng (ở đkc)?
Bài 2. Đốt cháy hoàn toàn a (g) bột Aluminium cần dùng hết 19,2g oxygen, phản ứng kết thúc, thu được b g Aluminium oxide (AlO3).
a, Lập PTHH của phản ứng trên?
b, Tính các giá trị a, b?
Bài 3. Trong phòng TN, người ta điều chế oxygen bằng cách nhiệt phân KClO, theo sơ đồ phản ứng sau: KClO3 KCl + O2 - đường
a, T...
Đọc tiếp
Bài 1. Cho 13g Zinc tác dụng với dd H,SO4. Tính: a, Khối lượng acid đã tham gia phản ứng? b, Khối lượng muối ZnSO, tạo thành? C, Thể tích khí hidro thu được sau phản ứng (ở đkc)? Bài 2. Đốt cháy hoàn toàn a (g) bột Aluminium cần dùng hết 19,2g oxygen, phản ứng kết thúc, thu được b g Aluminium oxide (AlO3). a, Lập PTHH của phản ứng trên? b, Tính các giá trị a, b? Bài 3. Trong phòng TN, người ta điều chế oxygen bằng cách nhiệt phân KClO, theo sơ đồ phản ứng sau: KClO3 KCl + O2 - đường a, Tính khối lượng KClO3 cần để điều chế 9,6g oxygen? b, Tính khối lượng KC1 tạo thành bằng 2 cách?
Bài 1 : Sửa ZnSO thành ZnSO4
\(n_{Zn}=\dfrac{13}{65}=0,2\left(mol\right)\)
Pt : \(Zn+H_2SO_4\rightarrow ZnSO_4+H_2\)
Theo Pt : \(n_{Zn}=n_{H2SO4}=n_{ZnSO4}=n_{H2}=0,2\left(mol\right)\)
a) \(m_{H2SO4}=0,2.98=19,6\left(g\right)\)
b) \(m_{ZnSO4}=0,2.161=32,2\left(g\right)\)
c) \(V_{H2\left(dkc\right)}=0,2.24,79=4,958\left(l\right)\)
Đúng 2
Bình luận (0)
Bài 3 :
\(n_{O2}=\dfrac{9,6}{32}=0,3\left(mol\right)\)
\(2KClO_3\xrightarrow[]{t^o}2KCl+3O_2\)
0,2<-----------0,2<----0,3
a) \(m_{KClO3}=0,2.122,5=24,5\left(g\right)\)
b) Cách 1 : \(m_{KCl}=0,2.74,5=14,9\left(g\right)\)
cách 2 : \(BTKl:m_{KClO3}=m_{KCl}+m_{O2}\)
\(\Rightarrow m_{KCl}=m_{KClO3}-m_{O2}=24,5-9,6=14,9\left(g\right)\)
Đúng 2
Bình luận (0)
Bài 2 : Sửa AlO3 thành Al2O3
\(n_{O2}=\dfrac{19,2}{32}=0,6\left(mol\right)\)
a) PTHH : \(4Al+3O_2\xrightarrow[]{t^o}2Al_2O_3\)
0,8<---0,6------>0,4
b) \(a=m_{Al}=0,8.27=21,6\left(g\right)\)
\(b=m_{Al2O3}=0,4.102=40,8\left(g\right)\)
Đúng 1
Bình luận (0)
bài 1. Cho 10,5 gam aluminium (Al) tác dụng với 20 gam dung dịch hydrochloric acid (HCl). Sau phản ứng thu được 15,5 gam dung dịch aluminium chloride (MgCl2) và m g khí hydrogen (H2).a. Xác định chất tham gia và sản phẩm.b. Viết phương trình chữ của phản ứng.c. Lập phương trình hóa học của phản ứng trên.d. Tính khối lượng m gam khí hydrogen sinh ra.. Tính khối lượng m gam khí hydrogen sinh ra.
Đọc tiếp
bài 1. Cho 10,5 gam aluminium (Al) tác dụng với 20 gam dung dịch hydrochloric acid (HCl). Sau phản ứng thu được 15,5 gam dung dịch aluminium chloride (MgCl2) và m g khí hydrogen (H2).
a. Xác định chất tham gia và sản phẩm.
b. Viết phương trình chữ của phản ứng.
c. Lập phương trình hóa học của phản ứng trên.
d. Tính khối lượng m gam khí hydrogen sinh ra.
. Tính khối lượng m gam khí hydrogen sinh ra.
a.
Chất tham gia : alunium , hydrochloric acid
Chất sản phẩm : aluminium chloride , khí hydrogen
b.
alunium + hydrochloric acid → aluminium chloride + khí hydrogen
c.
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
d.
\(m_{H_2}=m_{Al}+m_{HCl}-m_{AlCl_2}=10.5+20-15.5=15\left(g\right)\)
Đúng 2
Bình luận (0)