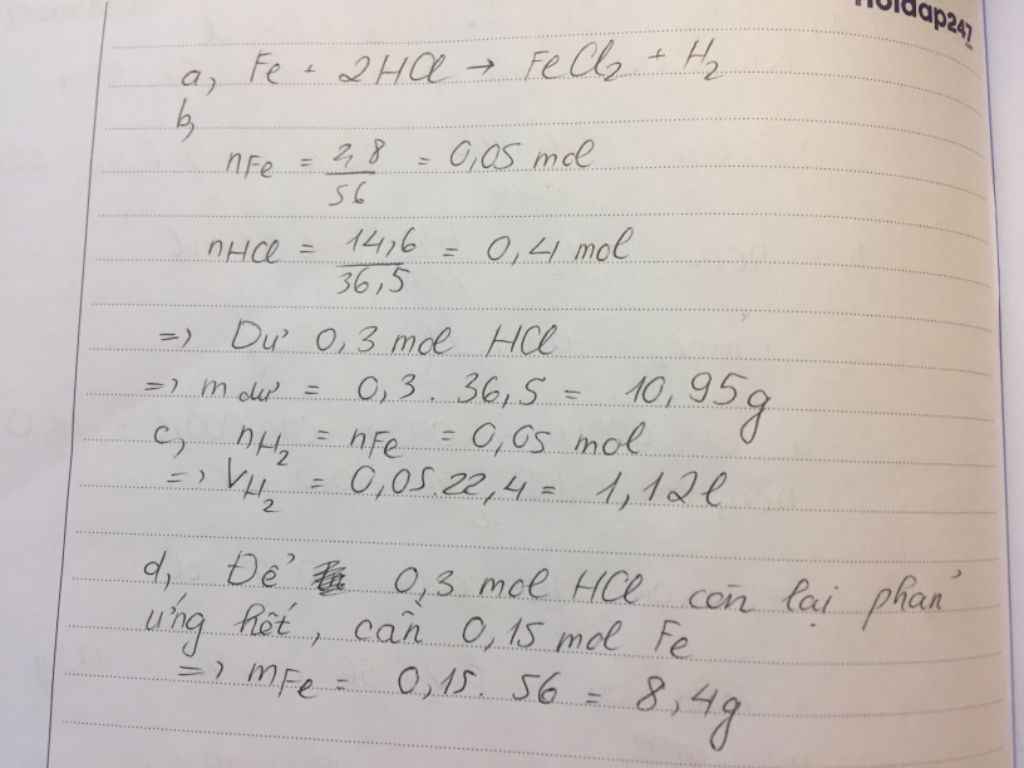Cho 5.6 Fe tác dụng với 100ml dung dịch HCl 1M thu được FeClo và khí H a. Viết PTHH b.chất nào dư sau phản ứng và dự bao nhiêu gam?

Những câu hỏi liên quan
Cho 11,2g Fe tác dụng vừa đủ với 250ml ddHCL 1M. Sau P/Ứ thu được dung dịch muối Sắt (II) Clorua và Hidro
a) Viết PTHH xảy ra
b) Tính thể tích khí sinh ra ở đktc
c) Sau phản ứng, chất nào dư, dư bao nhiêu gam?
Fe+2HCl->FeCl2+H2
0,125---0,25--0,125----0,125---
n Fe=11.2\56=0,2 mol
n HCl=0,25.1=0,25 mol
=> lập tỉ lệ : 0,2\1>0,25\2
=>HCl hết
=>VH2=0,125.22,4=2,8l
=>m Fe=0,125.56=7g
Đúng 2
Bình luận (0)
\(n_{Fe}=\dfrac{m}{M}=\dfrac{11,2}{56}=0,2\left(mol\right)\)
\(n_{HCl}=CM.V_{dd}=1.0,25=0,25\left(mol\right)\)
PTHH:\(2Fe+6HCl\rightarrow2FeCl_3+3H_2\)
TPƯ: 0,2 0,25
PƯ: 0,08 0,25 0,08 0,125
SPƯ: 0,12 0 0,08 0,125
\(V_{H_2}=n.22,4=0,125.22,4=2,8\left(l\right)\)
\(m_{Fedư}=n.M=0,12.56=6,72\left(g\right)\)
Đúng 0
Bình luận (1)
Hòa tan 13 gam Zn tác dụng với 150 ml dung dịch axit HCl 2 M, thu được dung dịch muối và khí H2 (đktc).
a) Viết PTHH của phản ứng
b) Chất nào còn dư sau phản ứng? Khối lượng dư là bao nhiêu?
c) Tính thể tích khí H2 thu được
\(a,PTHH:Zn+2HCl\rightarrow ZnCl_2+H_2\\ b,n_{Zn}=\dfrac{13}{65}=0,2\left(mol\right)\\ n_{HCl}=2\cdot0,15=0,3\left(mol\right)\)
Vì \(\dfrac{n_{Zn}}{1}>\dfrac{n_{HCl}}{2}\) nên sau p/ứ Zn dư
\(\Rightarrow n_{Zn}=\dfrac{1}{2}n_{HCl}=0,15\left(mol\right)\\ \Rightarrow m_{Zn}=0,15\cdot65=9,75\\ \Rightarrow m_{Zn\left(dư\right)}=13-9,75=3,25\left(g\right)\\ c,n_{H_2}=n_{Zn}=0,15\left(mol\right)\\ \Rightarrow V_{H_2}=0,15\cdot22,4=3,36\left(l\right)\)
Đúng 2
Bình luận (0)
Cho 6,5 gam kim loại Zn tác dụng với 500ml dung dịch HCl 1M. Sau phản ứng thu được muối ZnCl2 và khí Hydrogen. Sau phản ứng chất nào còn dư? Dư bao nhiêu?
\(n_{Zn}=\dfrac{6,5}{65}=0,1\left(mol\right);n_{HCl}=0,5.1=0,5\left(mol\right)\\ PTHH:Zn+2HCl\rightarrow ZnCl_2+H_2\\ Vì:\dfrac{0,5}{2}>\dfrac{0,1}{1}\Rightarrow Zn.hết,HCldư\\ n_{HCl\left(dư\right)}=0,5-2.0,1=0,3\left(mol\right)\\ m_{HCl\left(dư\right)}=0,3.36,5=10,95\left(g\right)\)
Đúng 1
Bình luận (0)
cho 11,2 gam kim loại Fe tác dụng với 200 ml dung dich HCL 2,5M, sau phản ứng thu được khí hydrogen và dung dịch D. Cho biết sau phản ứng chất nào còn dư?Dư bao nhiêu gam?
\(n_{Fe}=\dfrac{11,2}{56}=0,2mol\\ n_{HCl}=0,2.2,5=0,5mol\\ Fe+2HCl\rightarrow FeCl_2+H_2\\ \Rightarrow\dfrac{0,2}{1}>\dfrac{0,5}{2}\Rightarrow HCl.dư\\ n_{HCl,pư}=0,2.2=0,4mol\\ m_{HCl,dư}=\left(0,5-0,4\right).36,5=3,65g\)
Đúng 1
Bình luận (0)
Cho 2,8 gam sắt tác dụng với 14,6 gam dung dịch HCl nguyên chấta ).Viết phương trình phản ứng xảy rab).chất nào còn dư sau phản ứng và dư bao nhiêu gamc).tính thể tích khí H2 thu được (đktc). d).Nếu muốn cho phản ứng xảy ra hoàn toàn thì phải dùng thêm chất kia một lượng là bao nhiêu
Đọc tiếp
Cho 2,8 gam sắt tác dụng với 14,6 gam dung dịch HCl nguyên chất
a ).Viết phương trình phản ứng xảy ra
b).chất nào còn dư sau phản ứng và dư bao nhiêu gam
c).tính thể tích khí H2 thu được (đktc). d).Nếu muốn cho phản ứng xảy ra hoàn toàn thì phải dùng thêm chất kia một lượng là bao nhiêu
nFe = 2.8/56 = 0.05 (mol)
nHCl = 14.6/36.5 = 0.4 (mol)
Fe + 2HCl => FeCl2 + H2
1.........2
0.05......0.4
LTL : 0.05/1 < 0.4/2
=> HCl dư
mHCl (dư) = ( 0.4 - 0.1 ) * 36.5 = 10.95 (g)
VH2 = 0.05*22.4 = 1.12 (l)
nHCl (dư) = 0.4 - 0.1 = 0.3 (mol)
mFe cần thêm = 0.3/2 * 56 = 8.4 (g)
Đúng 1
Bình luận (0)
Cho 13g kẽm tác dụng với 0,3mol dung dịch HCl thu được muối ZnCl2 và khí hiđro ở đktc.
a) Viết PTHH
b) Sau khi kết thúc phản ứng thì chất nào còn dư và khối lượng dư bao nhiêu?
c) Tính thể tích khí hiđro ở đktc
Xem chi tiết
a)
\(Zn + 2HCl \to ZnCl_2 + H_2\)
b)
\(n_{Zn} = \dfrac{13}{65} = 0,2(mol)\)
Ta thấy : \(\dfrac{n_{Zn}}{1} = 0,2 > \dfrac{n_{HCl}}{2} = 0,15\) nên Zn dư.
Theo PTHH :
\(n_{Zn\ pư} = 0,5n_{HCl} = 0,15(mol)\\ \Rightarrow n_{Zn\ dư} = 0,2 - 0,15 = 0,05(mol)\\ \Rightarrow m_{Zn\ dư} = 0,05.65 = 3,25(gam)\)
c)
Ta có :
\(n_{H_2} = n_{Zn\ pư} = 0,15(mol)\\ \Rightarrow V_{H_2} = 0,15.22,4 = 3,36(lít)\)
Đúng 2
Bình luận (0)
cho 2,4 gam tác dụng với 100ml dung dịch HCL 1M sau khi PƯ kết thíc thu đc V lít khí ở đktc và dd A thêm dd AgNO3?cho đến dư vào dd A thu đc m gam kết tủa a viết pthh b.tính m,V
Cho 8.4 gam Fe tác dụng với dung dịch chứa 14,6 gam HCl phản ứng hoàn toàn thu được dung dịch A và khí H2
a,Chất nào dư và dư bao nhiêu gam
b, Tính khối lượng FeCl2 thu được trong dung dịch A
c, Tính khối lượng à thể tích khí (đktc) H2 thu được
mFe= 8,4/56= 0,15 mol
m HCl = 14,6/36,5=0,4 mol
PTHH: Fe +2HCl →FeCl2 +H2
Bđ: 0,15 0,4 0 0 mol
Pứ: o,15→0,3 0,15 0,15 mol
Sau pứ:0 0,1 0,15 0,15 mol
a. HCl dư: m =0,1.36,5=3,65 g
b. m FeCl2 = 0,15.127=19,05 g
c. m H2 = 0,15.2= 0,3 g
V H2= 0,15.22,4=3,36 (l)
Đúng 0
Bình luận (1)
Câu 3. Cho 4g MgO tác dụng hoàn toàn với 100ml dung dịch HCl nồng độ 4M.
a. Sau phản ứng chất nào dư? Dư bao nhiêu gam?
b. Tính nồng độ mol (CM) các dung dịch thu được sau phản ứng.
Ta có: \(n_{MgO}=\dfrac{4}{40}=0,1\left(mol\right)\)
\(n_{HCl}=4.100:1000=0,4\left(mol\right)\)
a. PTHH: MgO + 2HCl ---> MgCl2 + H2O
Ta thấy: \(\dfrac{0,1}{1}< \dfrac{0,4}{2}\)
Vậy HCl dư.
=> \(n_{dư}=\dfrac{0,1.2}{0,4}=0,5\left(mol\right)\)
=> \(m_{dư}=0,5.36,5=18,2\left(g\right)\)
b. Ta có: \(V_{dd_{MgCl_2}}=V_{HCl}=\dfrac{100}{1000}=0,1\left(lít\right)\)
Theo PT: \(n_{MgCl_2}=n_{MgO}=0,1\left(mol\right)\)
=> \(C_{M_{MgCl_2}}=\dfrac{0,1}{0,1}=1M\)
Đúng 1
Bình luận (1)