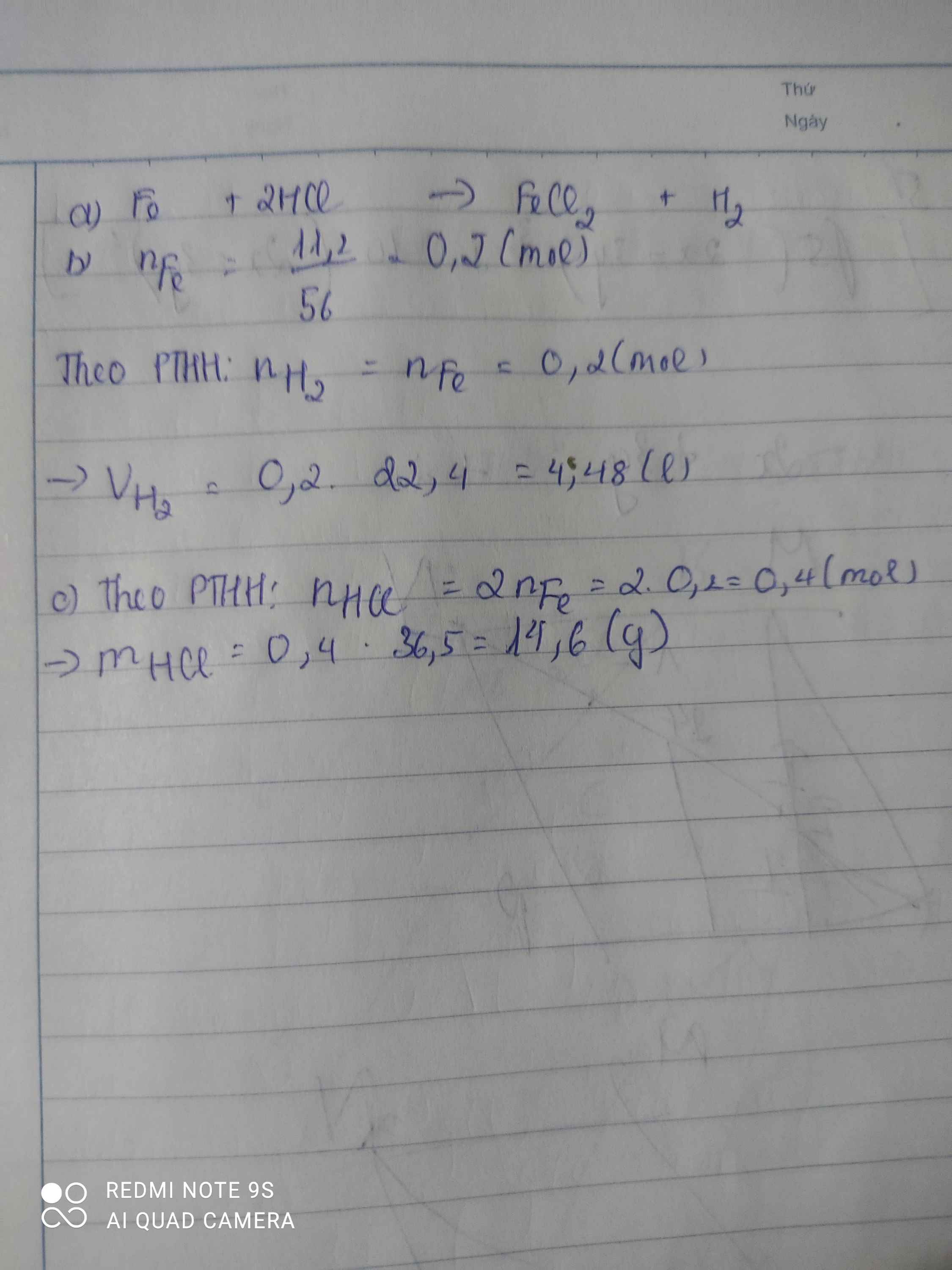hòa tan 11.2g sắt vào dung dịch axit clohidric thì thu đc sắt (II) clorua và khí hidro
a) lập PTHH của phản ứng trên
b) tính khối lượn axit clohidric đã dùng
c) tính khối lượn sắt (II) clorua thu đc
d) tính thể tích khí hidro sinh ra
e) nếu đem toàn bộ lượng khí hidro sinh ra ở trên cho qua 24g đồng (II) oxit thì sẽ thu đc tối đa là bao nhiêu gam đồng