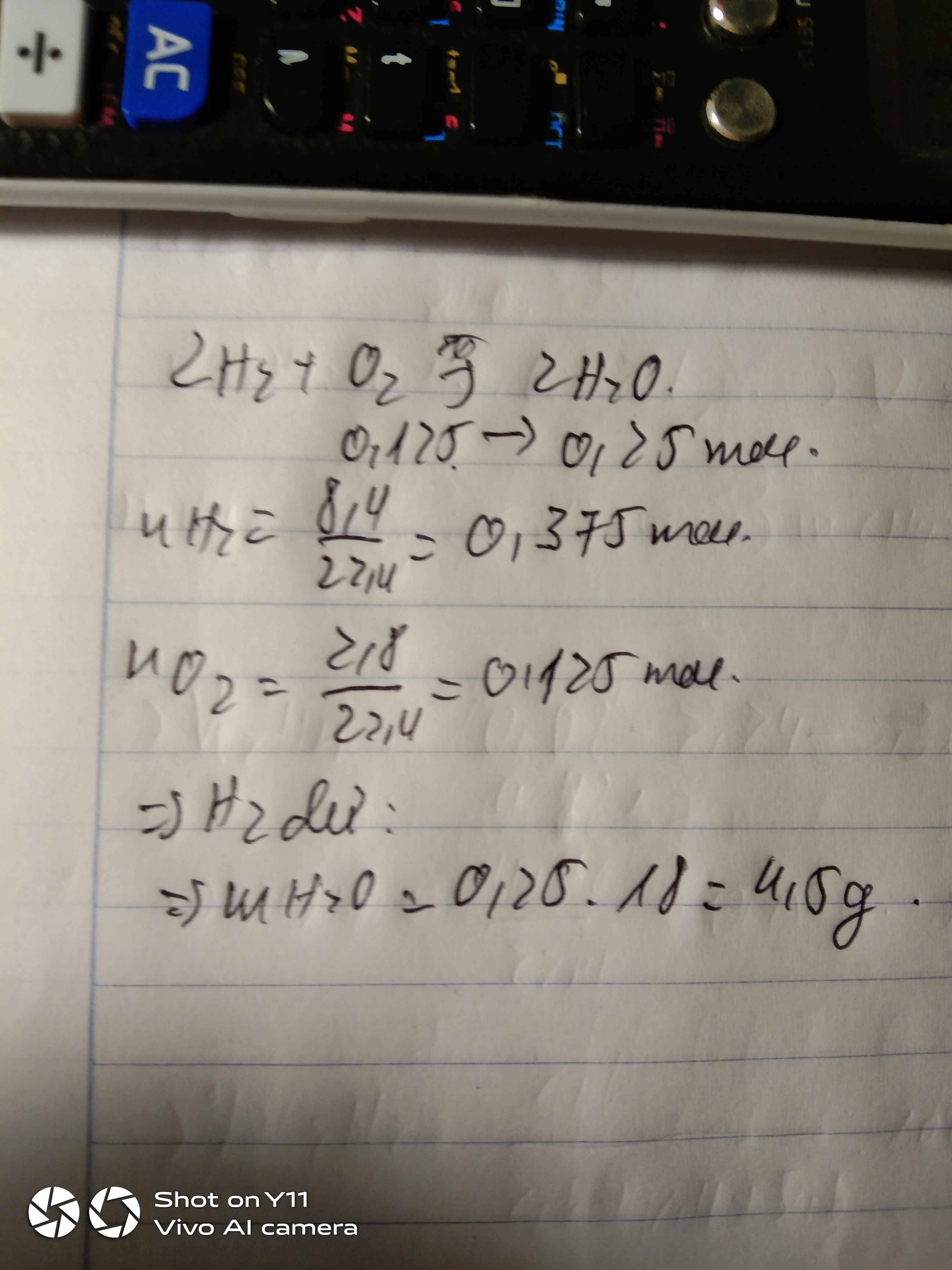Tính tổng số gam nước thu được khi cho 8,4 lít khí h2 tác dụng với 2,8 lít khí oxygen ( các khí đo ở đkc)

Những câu hỏi liên quan
tính số gam nước thu được khi cho 8,4 lít khí hidro tác dụng với 2,8 lít khí oxi (các thể tích khí đo ở đktc)
\(n_{H_2}=\dfrac{8.4}{22,4}=0,375\left(mol\right)\)
\(n_{O_2}=\dfrac{2.8}{22,4}=0,125\left(mol\right)\)
PTHH : 2H2 + O2 -> 2H2O
0,125 0,25
Ta thấy : 0,375 > 0,125 => H2 dư , O2 đủ
\(m_{H_2O}=0,25.18=4,5\left(g\right)\)
Đúng 4
Bình luận (0)
\(n_{H_2}=\dfrac{V_{H_2}}{22,4}=\dfrac{8,4}{22,4}=0,375mol\)
\(n_{O_2}=\dfrac{V_{O_2}}{22,4}=\dfrac{2,8}{22,4}=0,125mol\)
\(2H_2+O_2\rightarrow\left(t^o\right)2H_2O\)
0,375 >0,125 ( mol )
0,125 0,25 ( mol )
\(m_{H_2O}=n_{H_2O}.M_{H_2O}=0,25.18=4,5g\)
Đúng 2
Bình luận (1)
Tính số gam nước thu được khi cho 8,4 lít khí hiđro tác dụng với 2,8 lít oxi (các thể tích đo ở đktc).
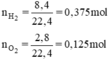
Phương trình hóa học của phản ứng tạo nước:
2H2 + O2 → 2H2O.
So sánh tỉ lệ 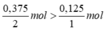 . Như vậy lượng H2 dư nên tính khối lượng nước sinh ra theo oxi.
. Như vậy lượng H2 dư nên tính khối lượng nước sinh ra theo oxi.
Theo phương trình trên ta có:
nH2O = 2. 0,125 = 0,25 mol.
mH2O = 0,25 .18 = 4,5g.
Đúng 0
Bình luận (0)
Bài 6 :tính số gam nước thu được khi cho 8,4 lít hidro tác dụng với 2,8 lít khí õi (các thể tích khí đo ở đktc )
GIúp mk với ạ :)))
\(n_{H_2}=\dfrac{8,4}{22,4}=0,375\left(mol\right)\)
\(n_{O_2}=\dfrac{2,8}{22,4}=0,125\left(mol\right)\)
PT: \(2H_2+O_2\underrightarrow{t^o}2H_2O\)
Xét tỉ lệ: \(\dfrac{0,375}{2}>\dfrac{0,125}{2}\), ta được H2 dư.
Theo PT: \(n_{H_2O}=2n_{O_2}=0,25\left(mol\right)\Rightarrow m_{H_2O}=0,25.18=4,5\left(g\right)\)
Đúng 2
Bình luận (0)
1/ khử 48 gam đồng (II) Oxit bằng khí hiđro.hãy
tính số gam đồng kim loại thu được
tính thể tích khí hiđro (đktc) cần dùng
2/ tính số gam nước thu được khi cho 8,4 lít khí hiđro tác dụng với 2,8 lít khí oxi (các thể tích khí đo ở đktc)
1/ \(CuO+H_2-^{t^o}\rightarrow Cu+H_2O\)
\(n_{Cu}=n_{CuO}=\dfrac{48}{80}=0,6\left(mol\right)\)
=> \(m_{Cu}=0,6.64=38,4\left(g\right)\)
\(n_{H_2}=n_{CuO}=0,6\left(mol\right)\)
=> \(V_{H_2}=0,6.22,4=13,44\left(l\right)\)
Đúng 3
Bình luận (0)
2. \(2H_2+O_2-^{t^o}\rightarrow2H_2O\)
\(n_{H_2}=0,375;n_{O_2}=0,125\)
Lập tỉ lệ \(\dfrac{0,375}{2}>\dfrac{0,125}{1}\)
=> Sau phản ứng H2 dư, tính theo số mol O2
\(n_{H_2O}=2n_{O_2}=0,25\left(mol\right)\)
=> \(m_{H_2O}=0,25.18=4,5\left(g\right)\)
Đúng 3
Bình luận (0)
Bài tập 1: Tính số gam nước thu được khi cho 2,24lít khí Hiđrô tác dụng với 2,8 lít khí ôxi. ( Các thể tích khí đo ở đktc)
PTHH: \(4H_2+O_2\underrightarrow{t^o}2H_2O\)
Ta có: \(\left\{{}\begin{matrix}n_{H_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\\n_{O_2}=\dfrac{2,8}{22,4}=0,125\left(mol\right)\end{matrix}\right.\)
Xét tỉ lệ: \(\dfrac{0,1}{4}< \dfrac{0,125}{1}\) \(\Rightarrow\) Oxi còn dư, Hidro p/ứ hết
\(\Rightarrow n_{H_2O}=0,05\left(mol\right)\) \(\Rightarrow m_{H_2O}=0,05\cdot18=0,9\left(g\right)\)
Đúng 3
Bình luận (0)
Tính số gam nước thu được khi cho 8,4 lít khí H2 tác dụng với 2,8 lít khí O2 (các thể tích đo ở đktc).
PTHH: 2H2 + O2 -to-> 2H2O
Ta có: \(\dfrac{8,4}{2}>\dfrac{2,8}{1}\)
=> H2 dư, O2 hết nên tính theo \(V_{O_2}\)
Theo PTHH và đề bài, ta có:
\(m_{H_2O}=2.\dfrac{2,8}{22,4}.18=4,5\left(g\right)\)
Đúng 0
Bình luận (1)
PTHH 2H2 + O2 -t0-> 2H2O
2mol 1mol 2mol
2V(lit) V(lit)
Ta thấy thể tích H2 lớn hơn 2 lần thể tích Oxi, do đó H2 dư nên ta tính số gam nước theo số mol oxi
Theo PTHH ta có nH2=nH2O
nH2O= 2,8 . 2 :22,4 = 0,25 (mol)
Vậy mH2O= 0,25 . 18 =4,5 (gam)
Đúng 0
Bình luận (0)
Xem thêm câu trả lời
Bài 1: Đốt cháy toàn bộ 6,72 lít khí H2 trong không khí
a) Viết PTHH
b)Tính khối lượng và thể tích của O2
Bài 2: Tính số g nước thu được khi cho 8,4 lít H2 tác dụng với 2,8 lít O2 (cả 2 chất đều ở đktc)
Bài 1 :
a) \(2H_2 + O_2 \xrightarrow{t^o} 2H_2O\)
b)
\(n_{O_2} = \dfrac{1}{2}n_{H_2} = \dfrac{1}{2}. \dfrac{6,72}{22,4} = 0,15(mol)\\ \Rightarrow V_{O_2} = 0,15.22,4 = 3,36(lít)\\ \Rightarrow m_{O_2} = 0,15.32 = 4,8(gam)\)
Đúng 2
Bình luận (0)
Bài 2 :
\(2H_2 + O_2 \xrightarrow{t^o} 2H_2O\)
Vì :\( \dfrac{n_{H_2}}{2} = \dfrac{8,4}{22,4.2} = 0,1875 > \dfrac{n_{O_2}}{1} = \dfrac{2,8}{22,4} =0,125\) nên Hidro dư
\(n_{H_2O} = 2n_{O_2} = 0,125.2 = 0,25(mol)\\ \Rightarrow m_{H_2O} = 0,25.18 = 4,5(gam)\)
Đúng 1
Bình luận (0)
Bài 1. a) PTHH: 2\(H_2\) + \(O_2\) ---> 2\(H_2O\) (Lập và cân bằng phương trình)
0,3 mol 0,15 mol 0,3 mol
b) + Số mol của \(H_2\)
\(n_{H_2}\) = \(\dfrac{V}{22,4}\) = \(\dfrac{6,72}{22,4}\) = 0,3 (mol)
+ Khối lượng của \(O_2\)
\(m_{O_2}\) = n . M = 0,15 . 32 = 4,8 (g)
+ Thể tích của \(O_2\)
\(V_{O_2}\) = n . 22,4 = 0,15 . 22,4 = 3,36 (lít)
Bài 2. 2\(H_2\) + \(O_2\) ---> 2\(H_2O\) (Lập và cân bằng phương trình sau khi viết lại phương trình một lần nữa)
0,25 mol 0,125 mol 0,25 mol
+ Số mol của \(H_2\)
\(n_{H_2}\) = \(\dfrac{V}{22,4}\) = \(\dfrac{8,4}{22,4}\) = 0,375 (mol)
+ Số mol của \(O_2\)
\(n_{O_2}\) = \(\dfrac{V}{22,4}\) = \(\dfrac{2,8}{22,4}\) = 0,125 (mol)
+ Tỉ lệ: \(H_2\) \(O_2\)
\(\dfrac{0,375}{2}\) 0,125
0,1875 > 0,125
=> \(H_2\) dư; \(O_2\) hết
+ Số g của \(H_2O\) (nước):
\(m_{H_2O}\) = n . M = 0,25 . 18 = 4,5 (g)
_______________________________
Có gì không đúng nhắn mình nha :))
Đúng 0
Bình luận (0)
Xem thêm câu trả lời
Cho 4,958 lít khí H2 tác dụng với 1,2395 lít khí O2. Tính khối lượng nước thu được (các khí đo được ở đktc)
\(n_{H_2}=\dfrac{V}{22,4}=\dfrac{4,958}{22,4}=\approx0,2\left(mol\right)\)
\(n_{O_2}=\dfrac{V}{22,4}=\dfrac{1,2395}{22,4}\approx0,05\left(mol\right)\)
\(PTHH:2H_2+O_2\rightarrow2H_2O\)
Ta có: \(\dfrac{n_{H_2}}{2}=\dfrac{0,2}{2}=0,1>\dfrac{n_{O_2}}{1}=\dfrac{0,05}{1}=0,05\)
→ Sau pư O2 hết, H2 dư
→ Theo \(n_{O_2}\)
Theo PTHH \(n_{H_2O}=2n_{O_2}=2.0,05=0,1\left(mol\right)\)
\(V_{H_2O\left(đktc\right)}=n.22,4=0,1.22,4=2,24\left(l\right)\)
Vậy ...
Đúng 3
Bình luận (0)
Cho 0,1 mol anđehit X tác dụng hoàn toàn với H2 thấy cần 6,72 lít khí hiđro (đo ở đktc) và thu được sản phẩm Y. Cho toàn bộ lượng Y trên tác dụng với Na dư thu được 2,24 lít khí H2 (đo ở đktc). Mặt khác, lấy 8,4 gam X tác dụng với dung dịch AgNO3/NH3 thu được 43,2 gam Ag kim loại.Xác định công thức cấu tạo của X? A.
O
H
C
–
C
≡
C
−
C
H
O
B. ...
Đọc tiếp
Cho 0,1 mol anđehit X tác dụng hoàn toàn với H2 thấy cần 6,72 lít khí hiđro (đo ở đktc) và thu được sản phẩm Y. Cho toàn bộ lượng Y trên tác dụng với Na dư thu được 2,24 lít khí H2 (đo ở đktc). Mặt khác, lấy 8,4 gam X tác dụng với dung dịch AgNO3/NH3 thu được 43,2 gam Ag kim loại.Xác định công thức cấu tạo của X?
A. O H C – C ≡ C − C H O
B. O H C – C H = C H − C H O
C. C H ≡ C − C H O
D. O H C – C H = C H C H 2 C H O