viết 3 công thức tính (%m,%n,%V) cho
a,CH4 trong khí metan gồm CH4 và tạp chất chơ
Bài 3: Tính thể tích khí oxi cần thiết để đốt cháy hoàn toàn lượng khí metan CH4 có trong 1m3 khi chứa 2% tạp chất không cháy. Các thể tích đo ở đktc.
Tính thể tích khí Oxi cần thiết để đốt cháy hoàn toàn khí metan CH4 có trong 1m3 khí chứa 2% tạp chất không cháy. Các thể tích đo ở đktc
1 m3 = 1000 lít
$V_{CH_4} = 1000.(100\% - 2\%) = 980(lít)$
$CH_4 + 2O_2 \xrightarrow{t^o} CO_2 + 2H_2O$
Theo PTHH :
$V_{O_2} =2 V_{CH_4} = 1960(lít)$
Câu 1: Đốt cháy 16g khí metan CH4 trong bình đựng khí oxi, thu được 44g khí cacbon đioxit CO2 và 36g nước.
a) Viết phản ứng hóa học
b) Viết công thức khối lượng và tính khối lượng khí oxi cần dùng?
a) PƯHH: \(CH_4+2O_2\xrightarrow[]{t^0}CO_2\uparrow+2H_2O\)
b) Theo định luật bảo toàn khối lượng, ta có:
\(m_{CH_4}+m_{O_2}=m_{CO_2}+m_{H_2O}\)
\(\Rightarrow m_{O_2}=m_{CO_2}+m_{H_2O}-m_{CH_4}=44+36-16=64\) (g)
viết công thức cấu tạo đầy đủ và thu gọn của các chất hữu cơ sau
a) C3H8
b) C3H6
c)C2H50H
d) c3H7cl
đốt cháy hoàn toàn khí metan thu được 1,12 lít khí co2 và hơi nước
a) tính thể tích khí oxi(đktc)
b)tính khối lượng nước
c)tính khối lượng CH4
Tính thể tích khí oxi cần thiết để đốt cháy hoàn toàn khí metan C H 4 có trong 1m3 khí chứa 2% tạp chất không cháy. Các thể tích đó được đo ở đktc.
Tính thể tích khí oxi cần thiết để đốt cháy hoàn toàn lượng khí metan CH4 có trong 1m3 khi chứa 2% tạp chất không cháy. Các thể tích đo ở đktc.
Ta có: 1 m3 = 1000 dm3 = 1000 lít
Trong 1 m3 có chứa 2% tạp chất nên lượng khí CH4 nguyên chất là:
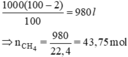
Phương trình phản ứng:
CH4 + 2O2  CO2 + 2H2O
CO2 + 2H2O
Từ phương trình ta có: nO2 = 2nCH4 = 2.43,75 = 87,5 mol
⇒ VO2 = 87,5.22,4= 1960 lít
Tính thể tích khí oxi cần thiết để đốt cháy hoàn toàn khí metan CH4 có trong 1 m3 khí chứa 2% tạp chất không cháy. Các thể tích đó được đo ở đktc.
VCH4(nguyênchất)=1000.98%=980(l)
⇒nCH4=\(\dfrac{980}{22,4}\)=43,75(mol)
CH4+2O2-to→CO2+2H2O
⇒nO2=87,5(mol)
⇒VO2=87,5.22,4=1960(l)=1,96(m3)
a) PTHH: \(CH_4+2O_2\underrightarrow{t^o}CO_2+2H_2O\)
b+c)
Vì trong chất khí, tỉ lệ số mol cũng chính là tỉ lệ về thể tích
\(\Rightarrow\left\{{}\begin{matrix}V_{CO_2}=V_{CH_4}=11,2\left(l\right)\\V_{O_2}=2V_{CH_4}=22,4\left(l\right)\end{matrix}\right.\)
Một hợp chất được tạo có công thức hóa học là Mn2Ox. PTK của nó nặng gấp 13,875 lần ptk của khí metan(CH4). Tìm CTHH của hc và tính hóa trị của Mn trong hc trên
Ta có :
$PTK = 55.2 = 16x = 13,875.M_{CH_4} = 13,875.16 = 222 \Rightarrow x = 7$
Vậy CTHH là $Mn_2O_7$
Vì Oxi có hóa trị II nên theo quy tắc hóa trị, hóa trị của Mn là VII
4. Cho 3( g) h2 khí gồm CH4 và C2H4 ( etilen) cần vừa đủ ( metan) V lít O2 (đkc), thu H2O và CO2 4,48 lít ( đkc). a, Viết PTHH . b, giá trị V . c, tính % thể tích các khí ban đầu
\(Đặt:\left\{{}\begin{matrix}a=n_{CH_4}\\b=n_{C_2H_4}\end{matrix}\right.\left(a,b>0\right)\\ a.CH_4+2O_2\underrightarrow{^{to}}CO_2+2H_2O\\ C_2H_4+3O_2\underrightarrow{^{to}}2CO_2+2H_2O\\ \Rightarrow\left\{{}\begin{matrix}16a+28b=3\\a+2b=\dfrac{4,48}{22,4}=0,2\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}a=0,1\\b=0,05\end{matrix}\right.\\ b.V_{O_2\left(đktc\right)}=22,4.\left(2a+3b\right)=22,4.\left(2.0,1+0,05.3\right)=7,84\left(l\right)\\ c.\%V_{CH_4}=\dfrac{a}{a+b}.100\%=\dfrac{0,1}{0,05+0,1}.100\approx66,667\%\\ \Rightarrow\%V_{C_2H_4}\approx33,333\%\)