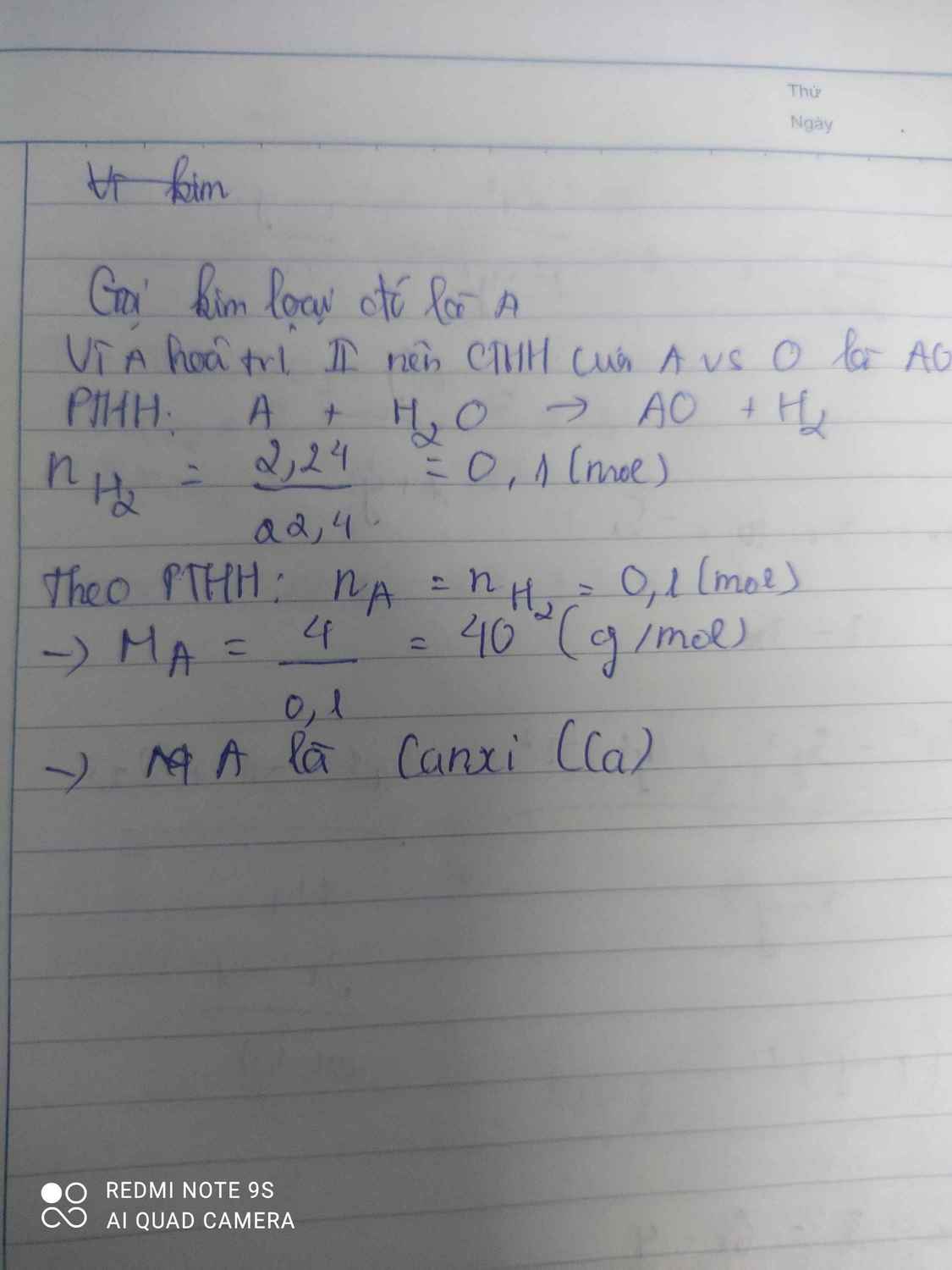cho 12,,4g Na2O hoà tan hoàn toàn trong 200gam H2O.Tính C% của đd thu được sau p/u

Những câu hỏi liên quan
Hoà tan hoàn toàn 12,4 ( gam) Na2O vào nước , sau phản ứng thu được 2 lít dung dịch a, Viết phương trình hoá học xảy ra b, Tính nồng độ mol của chất tan trong dd thu được
nNa2O= 12,4/62=0,2(mol)
a) PTHH: Na2O + H2O -> 2 NaOH
0,2_________0,2____0,4(mol)
b) VddNaOH=2(l)
=>CMddNaOH=0,4/0,2=2(M)
Chúc em học tốt!
Đúng 3
Bình luận (2)
Câu 1: Hoà tan hoàn toàn 4,18gam hỗn hợp A chứa hai kim loại (Na,K) vào H2O sau phản ứng thu được 1,568lít H2 ở đktc
a, Viết pthh
b, Tính khối lượng của mỗi khối lượng trong A
c, Tính mNaOH sau phản ứng
Câu 2: Hoà tan hỗn hợp gồm 12,4gam Na2O và 15,3gam BaO vào H2O sau phản ứng thu được Mg hỗn hợp bazơ. Tính mgam bazơ
Câu 1:
a, \(2Na+2H_2O\rightarrow2NaOH+H_2\)
\(2K+2H_2O\rightarrow2KOH+H_2\)
b, Ta có: \(23n_{Na}+39n_K=4,18\left(1\right)\)
Theo PT: \(n_{H_2}=\dfrac{1}{2}n_{Na}+\dfrac{1}{2}n_K=\dfrac{1,568}{22,4}=0,07\left(mol\right)\left(2\right)\)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}n_{Na}=0,08\left(mol\right)\\n_K=0,06\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}m_{Na}=0,08.23=1,84\left(g\right)\\m_K=0,06.39=2,34\left(g\right)\end{matrix}\right.\)
c, Theo PT: \(n_{NaOH}=n_{Na}=0,08\left(mol\right)\Rightarrow m_{NaOH}=0,08.40=3,2\left(g\right)\)
Đúng 1
Bình luận (0)
Câu 2:
\(n_{Na_2O}=\dfrac{12,4}{62}=0,2\left(mol\right)\)
\(n_{BaO}=\dfrac{15,3}{153}=0,1\left(mol\right)\)
PT: \(Na_2O+H_2O\rightarrow2NaOH\)
______0,2_______________0,4 (mol)
\(BaO+H_2O\rightarrow Ba\left(OH\right)_2\)
0,1___________________0,1 (mol)
⇒ m = mNaOH + mBa(OH)2 = 0,4.40 + 0,1.171 = 33,1 (g)
Đúng 1
Bình luận (0)
câu 1
\(n_{H_2\left(dktc\right)}=\dfrac{V}{22,4}=\dfrac{1,568}{22,4}=0,07\left(mol\right)\)
đặt `n_(Na)=a`, `n_K=b`
\(PTHH:2Na+2H_2O->2NaOH+H_2\)
tỉ lệ 2 : 2 : 2 ; 1
n(mol) a----->a------------>a------------>`1/2a`
\(PTHH:2K+2H_2O->2KOH+H_2\)
Tỉ lệ 2 : 2 : 2 ; 1
n(mol) b-->b------------->b-------->`1/2b`
ta có
\(\left\{{}\begin{matrix}23a+39b=4,18\\\dfrac{1}{2}a+\dfrac{1}{2}b=0,07\end{matrix}\right.< =>\left\{{}\begin{matrix}a=0,08\\b=0,06\end{matrix}\right.\)
\(m_{Na}=n\cdot M=0,08\cdot23=1,84\left(g\right)\\ m_K=0,06\cdot39=2,34\left(g\right)\\ m_{NaOH}=n\cdot M=0,08\cdot\left(23+16+1\right)=3,2\left(g\right)\)
Đúng 1
Bình luận (0)
Bài 1:Hoà tan 12,4g Na2O vào 100g H2O thì thu được dd A .Tính C%,CM của dd A
Bài 3:Đốt cháy hoàn toàn 6,2g P trong O2 dư rồi chia chất rắn thu được ra làm 2 phần = nhau.Đem phần 1 hoà tan vào 80g H2O thì thu được dd có C% là bao nhiêu?Hoà tan phần 2 vào m(g) H2O thì thu được dd 10%.Tính m
Bài 1: PTHH: Na2O + H2O → 2NaOH
Số mol của Na2O là: 12,4 : 62 = 0,2 mol
100 gam nước tương ứng với 100 ml nước = 0,1 lít
a) Số mol của NaOH là: 0,2 . 2 = 0,4 mol
Khối lượng chất tan NaOH là: 0,4 . 40 = 16 gam
Áp dụng định luật bảo toàn khối lượng để tính khối lượng dung dịch NaOH sau phản ứng là: 112,4 gam
C% dd sau pứ là: (16 : 112,4 ) . 100% = 14,235%
b) CM của dung dịch sau phản ứng là:
0,4 : 0,1 = 4M
Đúng 0
Bình luận (0)
Hoà tan hoàn toàn 4g một kim loại hoá trị ll vào nước, sau phản ứng thu được 2.24 lít khí (đktc). Kim loại đó là
đặt kim loại Hóa Trị II là X
pthh: X + 2H2O --> X(OH)2 + H2
số mol của H2:
\(n_{H_2}=\dfrac{V_{H_2}}{22.4}=\dfrac{2.24}{22.4}=0.1mol\)
=> số mol của X là 0.1
KL mol là:
\(M_X=\dfrac{m_x}{n_x}=\dfrac{4}{0.1}=40\) g/mol
=> X là Ca
Đúng 0
Bình luận (2)
Hoà tan hoàn toàn a gam hỗn hợp Fe2O3, Mg cần vừa đủ 200gam dung dịch HCl 18,25% thu được dung dịch A và 4,48 lít khí (đktc) .
- Viết các phương trình phản ứng xảy ra
- Tính % khối lượng mỗi chất trong hỗn hợp đầu
-
Fe2O3 + 6HCl --> 2FeCl3 + 3H2O
Mg + 2HCl --> MgCl2 + H2
-
\(n_{H_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
\(n_{HCl}=\dfrac{200.18,25}{100.36,5}=1\left(mol\right)\)
PTHH: Mg + 2HCl --> MgCl2 + H2
0,2<----0,4<---------------0,2
Fe2O3 + 6HCl --> 2FeCl3 + 3H2O
0,1<-----0,6
=> \(\left\{{}\begin{matrix}\%Mg=\dfrac{0,2.24}{0,2.24+0,1.160}.100\%=23,077\%\\\%Fe_2O_3=\dfrac{0,1.160}{0,2.24+0,1.160}.100\%=76,923\%\end{matrix}\right.\)
Đúng 1
Bình luận (0)
Hòa tan hoàn toàn 32gam SO3 vào 200gam dung dịch H2SO4 có nồng độ 10%. Tính C% của dung dịch thu được.
\(n_{SO_3}=\dfrac{32}{80}=0,4\left(mol\right)\)
PTHH: \(SO_3+H_2O\rightarrow H_2SO_4\)
\(n_{H_2SO_4}=n_{SO_3}=0,4\left(mol\right)\)
\(m_{H_2SO_4}=0,4\cdot98=39,2\left(g\right)\)
\(m_{H_2SO_4\text{ trong dd 10%}}=\dfrac{200\cdot10}{100}=20\left(g\right)\)
\(\sum m_{H_2SO_4}=20+39,2=59,2\left(g\right)\)
\(m_{\text{ dd H2SO4 10%}}=200+39,2=239,2\left(g\right)\)
\(C\%_{\text{ dd mới}}=\dfrac{59,2}{239,2}\cdot100\%\approx24,75\%\)
Hiện tượng: SO3 được đưa vào dd H2SO4, SO3 tác dụng với H2O trong dd tạo ra sản phẩm là H2SO4.
Đúng 1
Bình luận (0)
Hoà tan hoàn toàn 18,4 g hỗn hợp 2 muối cacbonnat của 2 kim loại thuộc nhóm IIA và thuộc 2 chu kì liên tiếp trong bảng tuần hoàn bằng dd HCl dư thu đc đd X và 4,48 l CO2.
1) XĐ 2 KL trên
2)khối lượng muối clorua thu đuọc =? Khi cô cạn dung dịch X
3)dẫn toàn bộ khí CO2 thu được vào 200 ml dung dịch NaOH 1M thu được dung dịch m gam muối khan. M = ?
HD:
Đặt công thức chung của 2 muối cacbonat là MCO3.
MCO3 + 2HCl ---> MCl2 + H2O + CO2
Số mol hh hai muối = số mol CO2 = 0,2 mol. Như vậy, phân tử khối trung bình của 2 kim loại là M = 18,4/0,2 - 60 = 32. Như vậy 2 kim loại cần tìm là Mg và Ca.
Khối lượng muối clorua = (32+71).0,2 = 20,6 g.
3) Số mol OH- = 0,2 mol = số mol CO2. Như vậy chỉ có p.ư sau:
CO2 + NaOH ---> NaHCO3
Số gam muối khan thu được là 84.0,2 = 16,8 g.
Đúng 0
Bình luận (1)
Cho bột sắt dư phản ứng hoàn toàn với 3,7185lit khí Cl2 (25 độ C, 1Bar). Sau phản ứng toàn bộ muối thu được hoà tan hoàn toàn trong 500ml nước cất. Nồng độ mol dung dịch thu được là:
0,3M
0,2M
0,15M
0,4M
\(n_{Cl_2}=\dfrac{0,99.3,7185}{0,082.\left(273+25\right)}=0,15\left(mol\right)\)
PTHH: 2Fe + 3Cl2 --to--> 2FeCl3
__________0,15-------->0,1________(mol)
=> \(C_{M\left(FeCl_3\right)}=\dfrac{0,1}{0,5}=0,2M\)
Đúng 0
Bình luận (0)
Hoà tan hỗn hợp gồm:
N
a
2
O
,
B
a
O
,
A
l
2
O
3
, FeO vào nước (dư), thu được dung dịch X và một chất rắn Y. Sục khí
C
O
2
đến dư vào dung dịch X, sau khi các phản ứng xảy ra hoàn toàn thu được kết tủa là A.
F
e...
Đọc tiếp
Hoà tan hỗn hợp gồm: N a 2 O , B a O , A l 2 O 3 , FeO vào nước (dư), thu được dung dịch X và một chất rắn Y. Sục khí C O 2 đến dư vào dung dịch X, sau khi các phản ứng xảy ra hoàn toàn thu được kết tủa là
A. F e ( O H ) 3 .
B. K 2 C O 3 .
C. A l ( O H ) 3 .
D. B a C O 3 .
Chọn C
Dung dịch X chứa: N a + , B a 2 + , A l O 2 - , có thể có O H - , chất rắn Y là FeO.
Sục C O 2 dư vào X thu được kết tủa là A l ( O H ) 3 .
C O 2 + 2 H 2 O + A l O 2 - → A l ( O H ) 3 ↓ + H C O 3 -
Đúng 0
Bình luận (0)
Có hỗn hợp gồm Al và một oxit sắt. Sau phản ứng nhiệt nhôm hoàn toàn thu được 96,6 g chất rắn. - Hoà tan chất rắn trong NaOH dư thu được 6,72 lít khí đktc và còn lại một phần không tan A. - Hoà tan hoàn toàn A trong H2SO4 đặc nóng được 30,24 lít khí B ở đktc. Công thức của sắt oxit là: A. Fe2O3 B. Fe3O4 C. FeO D. Không xác định
Đọc tiếp
Có hỗn hợp gồm Al và một oxit sắt. Sau phản ứng nhiệt nhôm hoàn toàn thu được 96,6 g chất rắn.
- Hoà tan chất rắn trong NaOH dư thu được 6,72 lít khí đktc và còn lại một phần không tan A.
- Hoà tan hoàn toàn A trong H2SO4 đặc nóng được 30,24 lít khí B ở đktc.
Công thức của sắt oxit là:
A. Fe2O3
B. Fe3O4
C. FeO
D. Không xác định
Đáp án B
Gọi công thức của oxit sắt là FexOy.
Vì hòa tan chất rắn sau phản ứng vào dung dịch NaOH dư có xuất hiện khí nên hỗn hợp sau phản ứng nhiệt nhôm gồm Fe, A12O3 và Al dư.
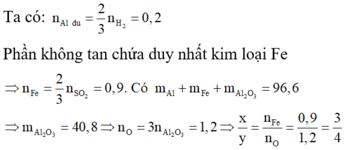
Đúng 0
Bình luận (0)