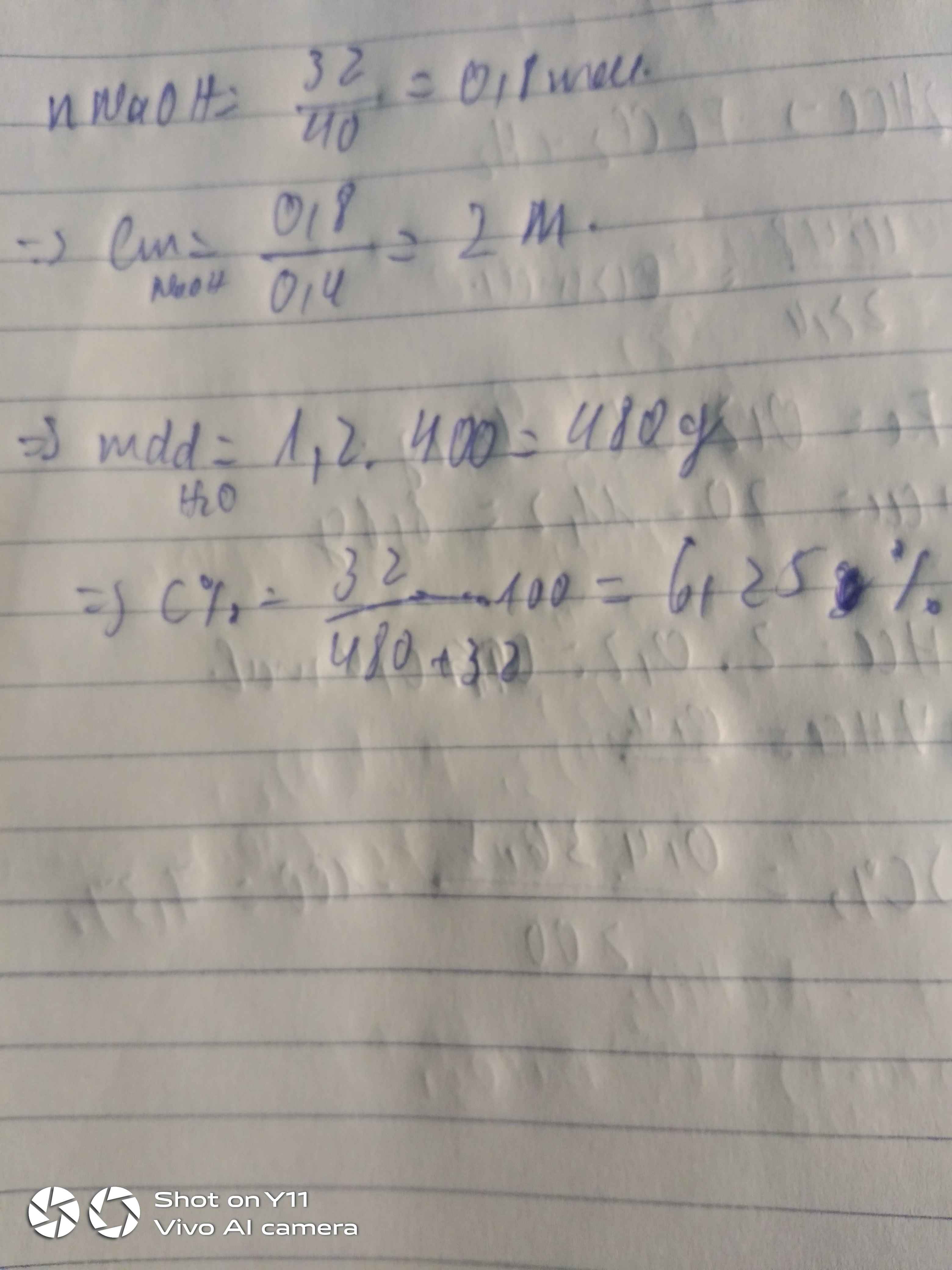Tính nồng độ phần trăm dung dịch 32g nano3 trong 1,5kg dd

Những câu hỏi liên quan
Hãy tính nồng độ phần trăm của những dung dịch sau:
a) 20g KCl trong 600g dung dịch.
b) 32g NaNO3 trong 2kg dung dịch.
c) 75g K2SO4 trong 1500g dung dịch.
Nồng độ phần trăm của các dung dịch là:

Đúng 1
Bình luận (0)
Cho 32g NaOH vào nước được 400ml dd có khối lượng riêng D=1,2g/ml . Tính nồng độ mol và nồng độ phần trăm của dung dịch
Dung dịch A chứa NaCl,KCl. Dd B chứa AgNO3. Cho A pư vừa đủ với B thu được 71,75g kết tủa và dd C chứa 2 muối NaNO3 và KNO3 có tỉ lệ nồng độ phần trăm lần lượt là 1,7:2,02. Tính số mol từng chất trong dung dịch A.
Phản ứng tạo khí E và Y là kim loại nhóm A.
⇒ Y là Al. D chỉ chứa 1 chất tan ⇒ D chứa NaCl.
+ Từ tỷ lệ mol 1:2 ⇒ Đặt nXCl2 = a và nAlCl3 = 2a
⇒ Trong dung dịch D có ∑nCl– = 8a và nNa2CO3 = 4a mol.
+ G chỉ chứa muối nitrat ⇒ NaCl (D) pứ hết, tạo nAgCl↓ = 8a mol và nNaNO3 = 8a mol.
+ Kết tủa 12 gam
Đúng 0
Bình luận (0)
Bài 1 : Hãy tính nồng độ phần trăm của những dung dịch sau :
a. 20 gam KCL trong 600 g dung dịch
b. 32 gam NANO3 trong 2kg dung dịch
\(a.\)
\(C\%_{KCl}=\dfrac{20}{600}\cdot100\%=3.33\%\)
\(b.\)
\(C\%_{NaNO_3}=\dfrac{32}{2000}\cdot100\%=1.6\%\)
Đúng 2
Bình luận (0)
Tính nồng độ phần trăm của dd chứa 20g KCL trong 600g dung dịch
\(C\%_{KCl}=\dfrac{20}{600}\cdot100\%=3.33\%\)
Đúng 1
Bình luận (0)
Tính nồng độ % của dung dịch kcl
30g kcl trong 700g dung dịch
Đúng 0
Bình luận (0)
ở 20°C, độ tan của NaNO3 là 88g. Hãy tính nồng độ phần trăm của dung dịch NaNO3 bão hào ở nhiệt đọ trên Giúp mik với =[[
Giả sử có 100 gam nước
\(m_{NaNO_3}=\dfrac{100.88}{100}=88\left(g\right)\)
=> \(C\%=\dfrac{88}{100+88}.100\%=46,81\%\)
Đúng 8
Bình luận (0)
Câu hỏi:a) có 10 gam kcl trong 300 gam dung dịch tính nồng độ phần trăm của dung dịch kcl b) hoà tan 3mol CuSO4 vào nước thu được 1500ml dung dịch, tính nồng độ mol của dd
a) \(C\%=\dfrac{m_{KCl}}{m_{ddKCl}}.100\%=\dfrac{10}{300}.100\%\approx3,3\%\)
b) Đổi: \(1500ml=1,5l\)
\(C_{MCuSO_4}=\dfrac{n}{V}=\dfrac{3}{1,5}=2M\)
Đúng 2
Bình luận (0)
Tính nồng độ mol/l các ion trong mỗi dd sau:
a) 100ml dd chứa 4,26 gam Al(NO3)3.
b) Tính nồng độ mol của ion Na+ trong dung dịch chứa NaNO3 0,1M,
Na2SO4 0,02M và NaCl 0,3M.
c) Dung dịch H2SO4 15% ( d= 1,1g/ml)
a) Ta có: \(n_{Al\left(NO_3\right)_3}=\dfrac{4,26}{213}=0,02\left(mol\right)\) \(\Rightarrow\left\{{}\begin{matrix}n_{Al^+}=0,02\left(mol\right)\\n_{NO_3^-}=0,06\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\left[Al^+\right]=\dfrac{0,02}{0,1}=0,2\left(M\right)\\\left[NO_3^-\right]=\dfrac{0,06}{0,1}=0,6\left(M\right)\end{matrix}\right.\)
b) Ta có: \(\left[Na^+\right]=0,1+0,02\cdot2+0,3=0,304\left(M\right)\)
c) Bạn xem lại đề !!
Đúng 0
Bình luận (0)
Tính nồng độ phần trăm của dung dịch thu đợc trong các trường hợp sau
a)pha thêm 30g nước vào 120g dd H2SO4 nồng độ 10%
b)hoà thêm 5g KOH vào 195g dd KOH nồng độ 8%
a) Ta có: \(m_{H_2SO_4}=120\cdot10\%=12\left(g\right)\) \(\Rightarrow C\%_{H_2SO_4}=\dfrac{12}{120+30}\cdot100\%=8\%\)
b) Ta có: \(m_{KOH}=195\cdot8\%=15,6\left(g\right)\) \(\Rightarrow C\%_{KOH}=\dfrac{15,6+5}{195+5}\cdot100\%=10,3\%\)
Đúng 1
Bình luận (0)