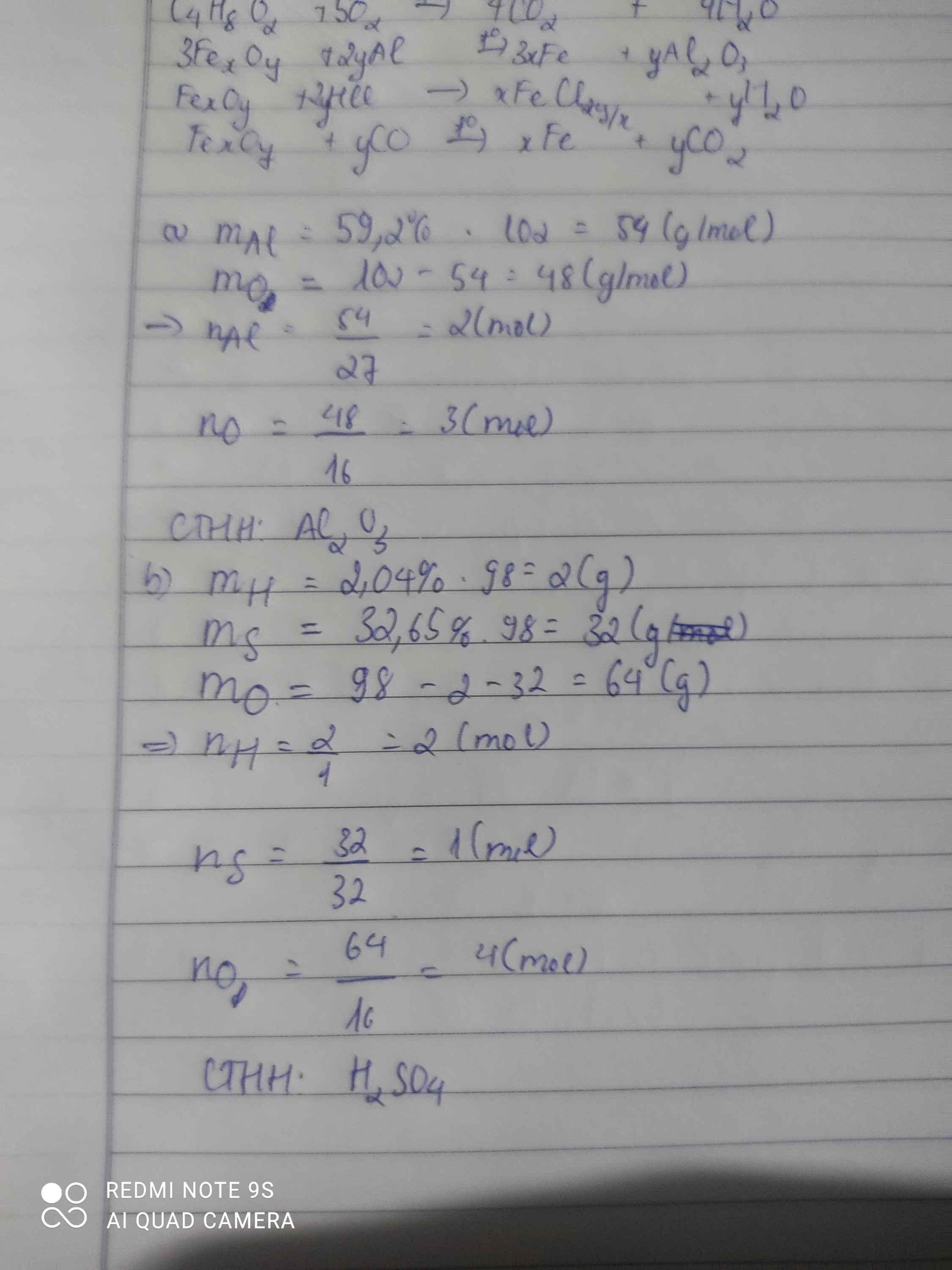câu 15: cho hợp chất x biết thành phần % các nguyên tố của hợp chất x là 40%cacbon , 53,33% oxi và 6,67% hidrogen . khối lượng mol là 60gam .tìm công thức háo học của hợp chất x.

Những câu hỏi liên quan
Một hợp chất X có thành phần phần trăm theo khối lượng : 40% Cacbon, 6,67% Hidro , 53,33% Oxi ; Phân tử khối là 60 đvc ; Hãy lập công thức hóa học của X
Trong 1 mol X:
\(n_C=\dfrac{60.40\%}{12}=2(mol)\\ n_H=\dfrac{60.6,67\%}{1}=4(mol)\\ n_O=\dfrac{60.53,33\%}{16}=2(mol)\\ \Rightarrow CTHH_X:C_2H_4O_2\)
Đúng 1
Bình luận (0)
Gọi CTHH của X là: \(\left(H_xC_yO_z\right)_n\)
Ta có: \(x:y:z=\dfrac{40\%}{12}:\dfrac{6,67\%}{1}:\dfrac{53,33\%}{16}=3,3:6,67:3,33=1:2:1\)
Vậy CTHH của X là: \(\left(HC_2O\right)_n\)
(Hình như đề sai)
Đúng 0
Bình luận (0)
Một hợp chất có thành phần các nguyên tố là 20%Mg ; 26,67%S và 53,33%O. Hãy xác định công thức hóa học của hợp chất (biết khối lượng mol là 120g) giải hộ mình với ạ gấp
Xem chi tiết
Trong một mol hợp chất có:
\(m_{Mg}=120.20\%=24g\)
\(\rightarrow n_{Mg}=\frac{24}{24}=1mol\)
\(m_S=120.26,67\%\approx32g\)
\(\rightarrow n_S=\frac{32}{32}=1mol\)
\(m_O=120.53,33\%\approx64g\)
\(\rightarrow n_O=\frac{64}{16}=4mol\)
Vậy CTHH của hợp chất \(MgSO_4\)
1) Một hợp chất chứa 59,2 % Al về khối lượng, còn lại là oxi. Xác định công thức hóa học của hợp chất biết khối lượng mol của hợp chất là 102 g/mol.
2) Xác định công thức hóa học của hợp chất A. Biết thành phần phần trăm về khối lượng các nguyên tố: 2,04% H, 32,65% S, còn lại là oxi, MA = 98 g/mol.
Bài 2:
\(Đặt.CTTQ.của.A:H_xS_yO_z\left(x,y,z:nguyên,dương\right)\\ Ta.có:\left\{{}\begin{matrix}x=\dfrac{98.2,04\%}{1}=2\\y=\dfrac{98.32,65\%}{32}=1\\z=\dfrac{98.\left(100\%-2,04\%-32,65\%\right)}{16}=4\end{matrix}\right.\\ \Rightarrow x=2;y=1;z=4\\ \Rightarrow CTHH:H_2SO_4\)
Đúng 5
Bình luận (1)
Bài 1: Sửa đề 59,2% Al thành 52,9% Al
\(Đặt.CTTQ:Al_xO_y\left(x,y:nguyên,dương\right)\\ x=\dfrac{52,9\%.102}{27}\approx2\\ \Rightarrow y\approx\dfrac{\left(100\%-52,9\%\right).102}{16}\approx3\\ \Rightarrow CTHH:Al_2O_3\)
Đúng 5
Bình luận (0)
1) \(m_{Al}=102.\dfrac{59,2}{100}=60,384\) (g)
\(m_O=102.\dfrac{100-59,2}{100}=41,616\) (g).
\(n_{Al}=\dfrac{m}{M}=\dfrac{60,384}{27}\approx2\) (mol).
\(n_O=\dfrac{m}{M}=\dfrac{41,616}{16}\approx3\) (mol).
-Công thức hóa học của hợp chất: \(Al_2O_3\).
2) \(m_H=98.\dfrac{2,04}{100}=1,9992\) (g).
\(m_S=98.\dfrac{32,65}{100}=31,997\) (g).
\(m_O=98.\dfrac{100-2,04-32,65}{100}=64,0038\) (g).
\(n_H=\dfrac{m}{M}=\dfrac{1,9992}{1}\approx2\) (mol).
\(n_S=\dfrac{m}{M}=\dfrac{31,997}{32}\approx1\) (mol).
\(n_O=\dfrac{m}{M}=\dfrac{64,0038}{16}\approx4\) (mol).
-Cộng thức hóa học của hợp chất A: \(H_2SO_4\)
Đúng 1
Bình luận (3)
a) Một hợp chất chứa 59,2 % Al về khối lượng, còn lại là oxi. Xác định công thức hóa học của hợp chất biết khối lượng mol của hợp chất là 102 g/mol.
b) Xác định công thức hóa học của hợp chất A. Biết thành phần phần trăm về khối lượng các nguyên tố: 2,04% H, 32,65% S, còn lại là oxi, MA = 98 g/mol.
Hãy tìm công thức hóa học của hợp chất X : Carbon = 40% , Hidrogen = 6,67% , còn lại là Oxygen . Tìm chất X
$Oxygen$ $=$ \(100\%-40\%-6,67\%=53,33\%7\)
- Gọi CTPT: \(C_xH_yO_z\)
\(\dfrac{\%C}{12}:\dfrac{\%H}{1}:\dfrac{\%O}{16}=\) \(3,33:6,67:3,33\) \(\simeq3:6:3\)
\(\rightarrow\) \(C_3H_6O_3\) đây là axit lactic.
Đúng 1
Bình luận (0)
Một hợp chất có thành phần các nguyên tố theo khối lượng là: 40% Cu; 20% S và 40%O. Xác định công thức hóa học của chất đó. Biết hợp chất có khối lượng mol là 160g/mol.
Gọi công thức hoá học của hợp chất là: \(Cu_xS_yO_z\)
Ta có: \(64x:32y:16z=40:20:40\)
\(\Rightarrow x:y:z=\dfrac{40}{64}:\dfrac{20}{32}:\dfrac{40}{16}\)
\(\Rightarrow x:y:z=1:1:4\)
Vậy công thức hoá học đơn giản của hợp chất B là: \(\left(CuSO_4\right)n\)
Ta lại có: \(\left(CuSO_4\right)n=160\)
\(\Rightarrow160n=160\)
\(\Rightarrow n=1\)
Vậy công thức hoá học của hợp chất B là:\(CuSO_4\)
Đúng 1
Bình luận (1)
Tìm công thức hóa học của hợp chất có thành phần các nguyên tố như sau : 55,189% K ; 14,623% P và còn lại là oxi . Biết 0,05 mol hợp chất có khối lượng là 10,6 gam
Một hợp chất X có thành phần khối lượng của các nguyên tố là: 32,4% Na; 22,54%S và 45,1%O. Khối lượng mol của hợp chất bằng 142 gam. Hãy xác định công thức hóa học của hợp chất X
Gọi CTHH là \(Na_xS_yO_z\)
\(x:y:z=\dfrac{\%Na}{23}:\dfrac{\%S}{32}:\dfrac{\%O}{16}=\dfrac{32,4}{23}:\dfrac{22,54}{32}:\dfrac{45,1}{16}=1,41:0,74:2,82=2:1:4\)Vậy CTĐGN(công thức đơn giản nhất) là \(Na_2SO_4\)
Lại có: \(M_X=142đvC\)\(\Rightarrow\left(Na_2SO_4\right)_n=142\Rightarrow n=1\)
Vậy CTHH là \(Na_2SO_4\)
Đúng 1
Bình luận (0)
Dạng 4 bài 3 Hợp chất hữu cơ A có thành phần khối lượng các nguyên tố như sau 40% C , 6,67% H, 53,33% O. a)Xác định công thức phân tử a biết Ma= 60 gam trên mol b) Viết công thức cấu tạo có thể có của A
a, Gọi CTPT của A là CxHyOz.
Ta có: \(x:y:z=\dfrac{40}{12}:\dfrac{6,67}{1}:\dfrac{53,33}{16}=1:2:1\)
⇒ CTĐGN của A là: (CH2O)n.
Mà: MA = 60 (g/mol)
\(\Rightarrow n=\dfrac{60}{12+2+16}=2\)
Vậy: A là C2H4O.
b, CTCT: CH3 - CHO.
Bạn tham khảo nhé!
Đúng 1
Bình luận (1)