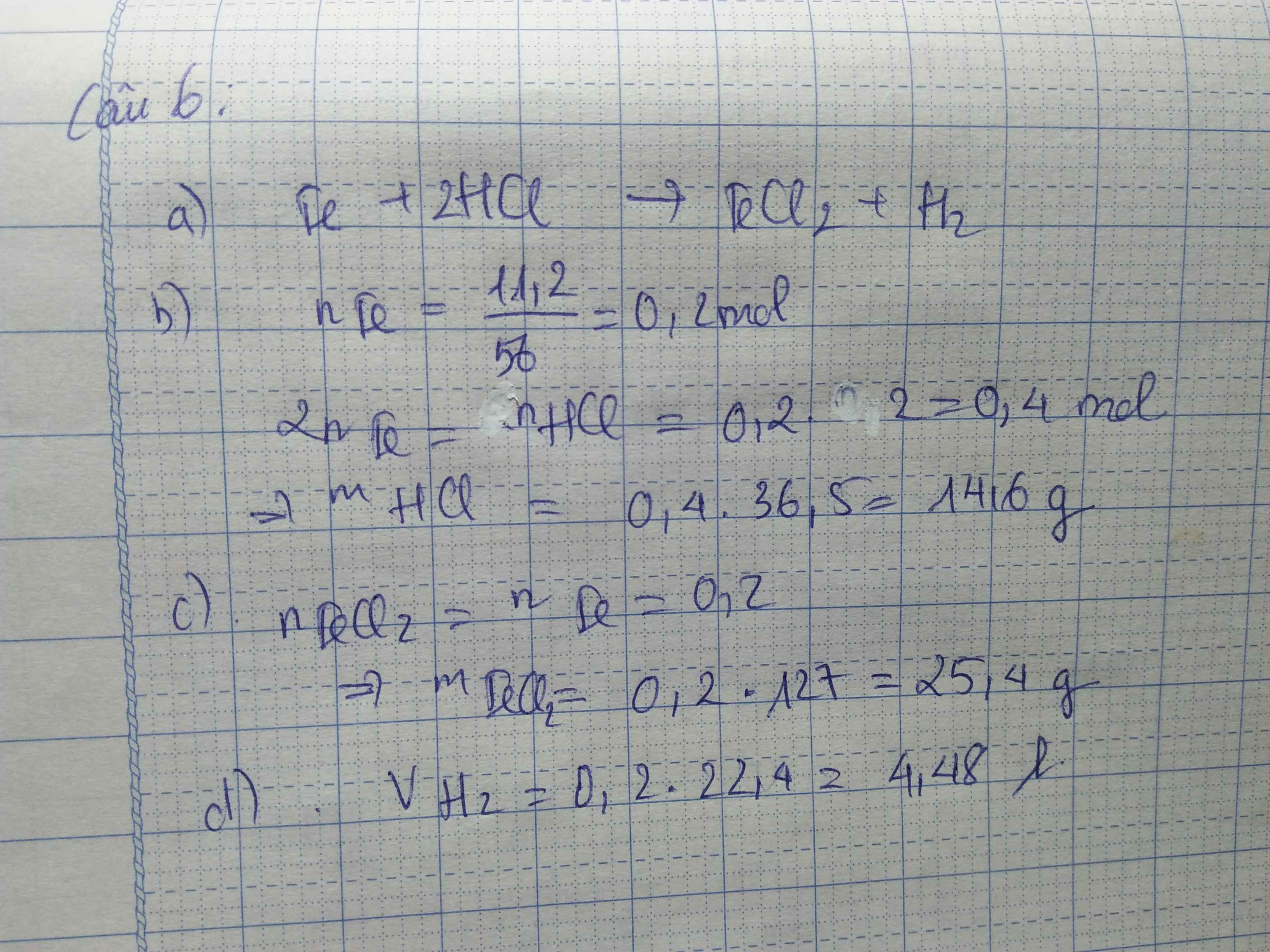cho 10,125 gam nhôm vào dung dịch axit clohyđric, tạo ra nhôm clorua khí hyddro

Những câu hỏi liên quan
đốt cháy 6.72 l khí clo(đktc) trong khí hidro tạo thành khí hidro clorua( hcl) hòa tan khí hcl vào nước được dung dịch axit clohidric(hcl). Hỏi với lượng axit thu được ở trên hòa tan được bao nhiêu gam nhôm để tạo ra nhôm clorua( AlCl3) và giải phóng bnh l khí hidro( đktc)
Cho 5.4 gam nhôm phản ứng hoàn toàn với dung dịch axit clohidric 3.65% tạo thành muối nhôm clorua và khí hidro
a)viết PTHH
b)tính thể tích khí hidro thu được
c)tính khối lương muối nhôm clorua tạo thành
d) tính khối lượng dung dịch axit clohidric cần dùng
a)
2Al + 6HCl → 2AlCl3 + 3H2
b) nAl = 5,4 : 27 = 0,2 mol
Theo tỉ lệ phản ứng => nH2 = 0,3 mol <=> VH2 = 0,3.22,4 = 6,72 lít.
c) nAlCl3 = nAl = 0,2 mol
=> mAlCl3 = 0,2. 133,5 = 26,7 gam.
d) nHCl cần dùng = 3nAl = 0,6 mol
=> mHCl = 0,6.36,5 = 21,9 gam
<=> mdd HCl cần dùng = \(\dfrac{21,9}{3,65\%}\) = 600 gam
Đúng 1
Bình luận (0)
Hòa tan hoàn toàn 5,4 gam nhôm vào dung dịch axit clohdric (HCl) tạo thành nhôm clorua (AlCl3) và khí hidro.
a. Viết phương trình hóa học.
b. Tính khối lượng kẽm clorua (AlCl3) tạo thành
\(n_{Al}=\dfrac{5,4}{27}=0,2mol\)
a)\(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
0,2 0,6 0,2 0,3
b)\(m_{AlCl_3}=0,2\cdot133,5=26,7g\)
Đúng 4
Bình luận (0)
a. 2Al (0,2 mol) + 6HCl \(\rightarrow\) 2AlCl3 (0,2 mol) + 3H2.
b. Số mol của nhôm là 5,4:27=0,2 (mol).
Khối lượng của nhôm clorua là 0,2.133,5=26,7 (g).
Đúng 0
Bình luận (0)
Bài 5:Cho 2,7g Al tác dụng với axit HCl thu được nhôm clorua AlCl3và khí hiđro.a.Viết PTHH của phản ứng xảy ra.b. Tính thểtích khí H2thu được ởĐKTC.c. Tính khối lượng nhôm clorua tạo thành.Bài 6:Thả11,2 gam bột sắt vào dung dịch axit clohiđric HCl đến khi bột sắt tan hết thu được a gam muối sắt (II) clorua FeCl2 và khí hiđro.a.Viết PTHH của phản ứng xảy ra..bTính khối lượng axit clohiđric đã tham gia phản ứng.c.Tính giá trị của a.d.Tính thể tích khí hiđro thu được (ở đktc).Giúp mình với mình cần...
Đọc tiếp
Bài 5:Cho 2,7g Al tác dụng với axit HCl thu được nhôm clorua AlCl3và khí hiđro.
a.Viết PTHH của phản ứng xảy ra.
b. Tính thểtích khí H2thu được ởĐKTC.
c. Tính khối lượng nhôm clorua tạo thành.
Bài 6:Thả11,2 gam bột sắt vào dung dịch axit clohiđric HCl đến khi bột sắt tan hết thu được a gam muối sắt (II) clorua FeCl2 và khí hiđro.
a.Viết PTHH của phản ứng xảy ra.
.bTính khối lượng axit clohiđric đã tham gia phản ứng.
c.Tính giá trị của a.d.Tính thể tích khí hiđro thu được (ở đktc).
Giúp mình với mình cần trong tối nay!
có thêm đc câu 6 thì tốt. Em cảm ơn ạ
Đúng 0
Bình luận (0)
Hòa tan 13,5 gam nhôm (Al) trong dung dịch axit clohiđric(HCl) thu đc nhôm Clorua(AlCl3)
và giải phóng khí Hiđro (H2)
a, Tính khối lượng Nhôm Clorua thu được
b, Tính thể tích khí oxi tạo thành (đktc)
c, Dân toàn bộ khí sinh ra đi qua bình đựng 64,8 gam sắt (II) oxit(FeO). Tính khối lượng kim loại sắt sinh ra sau phản ứng
Help me
\(n_{Al}=\dfrac{13.5}{27}=0.5\left(mol\right)\)
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
\(0.5........................0.5......0.75\)
\(a.\)
\(m_{AlCl_3}=0.5\cdot133.5=66.75\left(g\right)\)
\(b.\)
\(V_{H_2}=0.75\cdot22.4=16.8\left(l\right)\)
\(c.\)
\(n_{FeO}=\dfrac{64.8}{72}=0.9\left(mol\right)\)
\(FeO+H_2\underrightarrow{t^0}Fe+H_2O\)
\(0.75.....0.75...0.75\)
\(\Rightarrow FeOdư\)
\(m_{Fe}=0.75\cdot56=42\left(g\right)\)
Đúng 1
Bình luận (1)
a)mol Al= 0.5
pthh: 2Al + 6HCl -----> 2AlCl\(_3\) + 3H\(_2\)
0.5mol Al= 0,5 mol AlCl\(_3\) ---> m\(_{AlCl}\)\(_3\)=0,5*(27+35,5*3)=66.75
c) pthh: FeO + H\(_2\) --\(^{to}\)-> Fe + H\(_2\)O
mol\(_{FeO}\)=64,8/(56+16)=0,9
mol\(_{H_{ }2}\)=0.75
mol\(h2\)<mol\(_{FeO}\)---->H2 hết, FeO dư
m\(_{Fe}\)=0,75*56=42(g)
Đúng 0
Bình luận (0)
hòa tan 13,5g nhôm vào dung dịch có chứa 14,6g axit clohidric (HCL) thu được nhôm clorua và khí hidro a,tính khối lượng nhôm clorua tạo thành b,tính thể tích hidro thoát ra ở đktc c,tính khối lượng chất còn dư sau phản ứng
Đọc tiếp
hòa tan 13,5g nhôm vào dung dịch có chứa 14,6g axit clohidric (HCL) thu được nhôm clorua và khí hidro a,tính khối lượng nhôm clorua tạo thành b,tính thể tích hidro thoát ra ở đktc c,tính khối lượng chất còn dư sau phản ứng
nAl = 13,5/27 = 0,5 (mol)
nHCl = 14,6/36,5 = 0,4 (mol)
PTHH: 2Al + 6HCl -> 2AlCl3 + 3H2
LTL: 0,5/2 > 0,4/6 => Al dư
nAl (p/ư) = nAlCl3 = 0,4/3 = 2/15 (mol)
mAlCl3 = 133,5 . 2/15 = 17,8 (g)
nH2 = 0,4/2 = 0,2 (mol)
VH2 = 0,2 . 22,4 = 4,48 (l)
mAl (dư) = (0,5 - 2/15) . 27 = 9,9 (g)
Đúng 1
Bình luận (0)
Bài 8 : Cho 5,4 gam nhôm phản ứng với 200gdung dịch axit clohiđric ( đủ ) tạo thành muối nhôm clorua về khí hiđro . Viết PTHH b ) Tính thể tích khí hiđro thu được ( đktc ) c ) Tính nồng độ % dung dịch axit đã dùng ? ) Tính nồng độ % dung dịch muối nhôm tạo thành ? Dẫn khí sinh ra qua đồng ( II ) oxit thu được m ( g ) chất rắn . Tính m ( g ) ? được
a) pt: 2Al + 6HCl \(\rightarrow\) 2AlCl3 + 3H2
nAl = \(\dfrac{5,4}{27}=0,2mol\)
Theo pt: nH2 = \(\dfrac{3}{2}nAl=0,3mol\)
=> VH2 = 0,3.22,4 = 6,72lit
c) nHCl = 3nAl = 0,6mol
=> mHCl = 21,9g
=> C% = \(\dfrac{21,9}{200}.100\%=10,95\%\)
d) Bảo toàn khối lượng
mdung dich muối = mAl + mHCl - mH2
= 5,4 + 200 - 0,3.2 = 204,8g
Theo pt:nAlCl3 = nAl = 0,2mol
=> mAlCl3 = 0,2.133,5 = 26,7g
=> C%dd muối = \(\dfrac{26,7}{204,8}.100\%=13,03\%\)
e) H2 + CuO \(\xrightarrow[]{t^o}\) Cu + H2O
nCu = nH2 = 0,3mol
=> mCu = 0,3.64 = 19,2g
Đúng 2
Bình luận (0)
ở ngoài ko thấy chỗ C% nên ấn vào câu hỏi mới ra nha
Đúng 1
Bình luận (0)
Cho 3,375 gam nhôm tác dụng vừa đủ với dung dịch axit clohiđric sơ đồ phản ứng:
Al + HCl ---> AlCl3 + H2
a tính thể tích khí hidro được sinh ra ở điều kiện tiêu chuẩn b tính khối lượng muối nhôm clorua AlCl3 tạo thành
Xem chi tiết
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
\(n_{Al}=\dfrac{3,375}{27}=0,125\)
\(\Rightarrow n_{H_2}=\dfrac{0,125}{2}.3=0,1875mol\) \(\Rightarrow V_{H_2}=0,1875.22,4=4,2l\)
\(n_{AlCl_3}=n_{Al}=0,125mol\) \(\Rightarrow m_{AlCl_3}=0,125.133,5=16,6875g\)
Đúng 2
Bình luận (0)
Đốt cháy hoàn toàn 5,4 gam nhôm vào dung dịch axit clohidric thu được muối nhôm clorua (AlCl3) và khí hidro (đktc)
a) Viết phương trình hóa học
b) Tính khối lượng muối AlCl3
c) Tính thể tích khí hidro sinh ra
a, PT: \(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
Ta có: \(n_{Al}=\dfrac{5,4}{27}=0,2\left(mol\right)\)
Theo PT: \(\left\{{}\begin{matrix}n_{AlCl_3}=n_{Al}=0,2\left(mol\right)\\n_{H_2}=\dfrac{3}{2}n_{Al}=0,3\left(mol\right)\end{matrix}\right.\)
a, Ta có: \(m_{AlCl_3}=0,2.133,5=26,7\left(g\right)\)
b, Ta có: \(V_{H_2}=0,3.22,4=6,72\left(l\right)\)
Bạn tham khảo nhé!
Đúng 2
Bình luận (2)
PTHH: \(2Al+6HCl\rightarrow2AlCl_3+3H_2\uparrow\)
Ta có: \(n_{Al}=\dfrac{5,4}{27}=0,2\left(mol\right)\)
\(\Rightarrow\left\{{}\begin{matrix}n_{AlCl_3}=0,2mol\\n_{H_2}=0,3mol\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}m_{AlCl_3}=0,2\cdot133,5=26,7\left(g\right)\\V_{H_2}=0,3\cdot22,4=6,72\left(l\right)\end{matrix}\right.\)
Đúng 1
Bình luận (0)