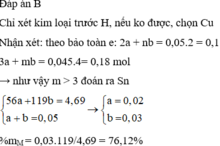Bài 8: Đốt cháy hoàn toàn 7,6 gam hỗn hợp Cu và Mg trong oxi ở nhiệt độ cao, thu được hỗn hợp 2 oxit trong đó 20% MgO. Hòa tan hỗn hợp này bằng dung dịch H2SO4 0,5M.
a. Xác định khối lượng mỗi kim loại trong hỗn hợp ban đầu.
b. Tính thể tích dung dịch H2SO4 loãng cần dùng để hòa tan hết các oxit ở trên.