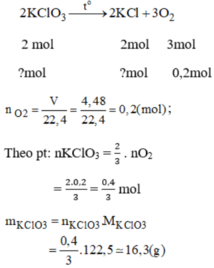Trong phòng thí nghiệmđểcó 6,72 lít khí oxi (ởđktc) thì cần dùng bao nhiêu gam:
a. KMnO4
b. KClO3

Những câu hỏi liên quan
Để điều chế khí oxi trong phòng thí nghiệm, đem nhiết phân KClO3
a, Nếu nung 3,675g KClO3 thì thể tích khí oxi thu được bao nhiêu lít ở đktc?
b, Nếu thu được 11,2 lít khí oxi ở đktc thì khối lượng KClO3 cần dùng là bao nhiêu g?
\(a.\)
\(n_{KClO_3}=\dfrac{3.675}{122.5}=0.03\left(mol\right)\)
\(2KClO_3\underrightarrow{t^0}2KCl+3O_2\)
\(0.03........................0.045\)
\(V_{O_2}=0.045\cdot22.4=1.008\left(l\right)\)
\(n_{O_2}=\dfrac{11.2}{22.4}=0.5\left(mol\right)\)
\(\Rightarrow n_{KClO_3}=\dfrac{0.5\cdot2}{3}=\dfrac{1}{3}mol\)
\(\Rightarrow m_{KClO_3}=\dfrac{1}{3}\cdot122.5=40.83\left(g\right)\)
Đúng 2
Bình luận (0)
Trong phòng thí nghiệm, người ta nhiệt phân Kali clorat KClO3 thu được Kaliclorua và khí Oxi
a. Muốn điều chế được 6,72 lít khí O2 ở đktc cần dùng bao nhiêu g KClO3?
b. Nếu có 490g KClO3 tham gia phản ứng sẽ thu được bao nhiêu g chất rắn và chất khí?
a) \(n_{O_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
PTHH: 2KClO3 --to--> 2KCl + 3O2
0,2<-------------------0,3
=> \(m_{KClO_3}=0,2.122,5=24,5\left(g\right)\)
b) \(n_{KClO_3}=\dfrac{490}{122,5}=4\left(mol\right)\)
PTHH: 2KClO3 --to--> 2KCl + 3O2
4-------------->4---->6
=> \(m_{KCl}=4.74,5=298\left(g\right)\)
=> \(m_{O_2}=6.32=192\left(g\right)\)
Đúng 2
Bình luận (0)
2KClO3 \(\underrightarrow{t^o}\) 2KCl + 3O2
a, \(n_{O_2}=\dfrac{6,72}{22,4}=0,3mol\\ n_{KClO_3}=\dfrac{0,3.2}{3}=0,2mol\\ m_{KClO_3}=0,2.122,5=24,5g\)
b, \(n_{KClO_3}=\dfrac{490}{122,5}=4mol\)
\(\Rightarrow m_{KCl}=4.74,5=298g\)
\(n_{O_2}=\dfrac{4.3}{2}=6mol\\ m_{O_2}=6.32=192g\)
Đúng 0
Bình luận (0)
Để điều chế khí oxi trong phòng thí nghiệm người ta nhiệt phân KMnO4 ở nhiệt độ cao
a) Để thu được 22,4 lít khí oxi ở đktc thì cần dùng bao nhiêu gam KMnO4
b) Dùng lượng khí oxi trên để đốt than (thành phần chính là cacbon C). Tính lượng CO2 sinh ra ở đktc
"M.n cứu em bài này với ạ không là em sắp thi rồi ạ"
a. \(n_{O_2}=\dfrac{22.4}{22.4}=1\left(mol\right)\)
PTHH : 2KMnO4 ----to----> K2MnO4 + MnO2 + O2
2 1
\(m_{KMnO_4}=2.158=316\left(g\right)\)
b. PTHH : C + O2 ---to--->CO2
1 1 1
\(m_{CO_2}=1.44=44\left(g\right)\)
Đúng 2
Bình luận (0)
a. n O 2 = 22.4 22.4 = 1 ( m o l ) PTHH : 2KMnO4 ----to----> K2MnO4 + MnO2 + O2 2 1 m K M n O 4 = 2.158 = 316 ( g ) b. PTHH : C + O2 ---to--->CO2 1 1 1 m C O 2 = 1.44 = 44 ( g )
Đúng 0
Bình luận (0)
Câu 3: K = 39; Cl = 35,5; O = 16. Trong phòng thí nghiệm để điều chế được 6,72 lít oxi (đktc) thì cần bao nhiêu gam Kali clorat (KClO3): *
nO2=6,72/22,4=0,3(mol)
PTHH: 2 KClO3 -to->2 KCl +3 O2
Ta có: nKClO3=2/3. 0,3=0,2(mol)
=>mKClO3=0,2.122,5=24,5(g)
Đúng 4
Bình luận (0)
trong phòng thí nghiệm để thu khí oxi ng ta dùng phản ứng sau:2KClO3→2KCl+3O2↑Điều kiện: khi bị nung nónga, tính khối lượng của kclo3 đem nung để thu được 11,2 lít oxib, nếu dùng kMNO4 thì cần nung bao nhiêu gam để thu được lượng oxi như trên
Đọc tiếp
trong phòng thí nghiệm để thu khí oxi ng ta dùng phản ứng sau:
2KClO3→2KCl+3O2↑
Điều kiện: khi bị nung nóng
a, tính khối lượng của kclo3 đem nung để thu được 11,2 lít oxi
b, nếu dùng kMNO4 thì cần nung bao nhiêu gam để thu được lượng oxi như trên
a)\(n_{O_2}=\dfrac{11,2}{22,4}=0,5\left(m\right)\)
\(PTHH:2KClO_3\underrightarrow{t^o}2KCl+3O_2\)
tỉ lệ :2 2 3
số mol :0,3 0,3 0,5
\(m_{KClO_3}=0,3.122,5=36,75\left(g\right)\)
b)\(PTHH:2KMnO_4\underrightarrow{t^o}K_2MnO_4+MnO_2+O_2\)
tỉ lệ :2 1 1 1
số mol :1 0,5 0,5 0,5
\(m_{KMnO_{\text{4}}}=1.158=158\left(g\right)\)
Đúng 2
Bình luận (0)
\(n_{O_2}=\dfrac{V}{24,79}=\dfrac{11,2}{24,79}\approx0,45\left(mol\right)\)
\(PTHH:2KClO_3\underrightarrow{t^o}2KCl+3O_2\uparrow\)
2 2 3
0,3 0,3 0,3
\(m_{KClO_3}=n.M=0,3.\left(39+35,5+16.3\right)=36,75\left(g\right).\)
Đúng 2
Bình luận (0)
Đốt cháy hoàn toàn 6,72 gam kim loại sắt trong lọ đựng khí oxi
a. Viết phương trình phản ứng.
b. Tính thể tích khí oxi cần dùng ở điều kiện tiêu chuẩn.
c. Để điều chế được lượng khí oxi tham gia phản ứng trên, trong phòng thí nghiệm cần dùng bao nhiêu kali clorat.
(Fe:56; O:16; K:39; Cl:35,5; H:1; Zn:65)
Mọi người giúp mình với ạ.
a.b.\(n_{Fe}=\dfrac{6,72}{56}=0,12mol\)
\(3Fe+2O_2\rightarrow\left(t^o\right)Fe_3O_4\)
0,12 0,08 ( mol )
\(V_{O_2}=0,08.22,4=1,792l\)
c.\(2KClO_3\rightarrow\left(t^o,MnO_2\right)2KCl+3O_2\)
4/75 0,08 ( mol )
\(m_{KClO_3}=\dfrac{4}{75}.122,5=6,533g\)
Đúng 3
Bình luận (1)
nFe = 6,72 : 56 = 0,12 (mol)
pthh : 3Fe + 2O2 -t--> Fe3O4
0,12 --> 0,08 (mol)
=> VO2 = 0,08 . 22,4 = 1,792 (L)
pthh: 2KClO3 -t--> 2KCl + 3O2
0,053<------------------ 0,08 (mol)
=> mKClO3 = 0,053 . 122,5 = 6,53 (G)
Đúng 2
Bình luận (0)
câu 9 : trong phòng thí nghiệm điều chế khí oxi bằng cách nhiệt phân muối kaliclorat
a) viết phương trình phản ứng
b) muốn điều chế 4,48 gam khí oxi (đktc) cần dùng bao nhiêu gam KCLO3 sau phản ứng thu được bao nhiêu gam chất rắn
a) 2KClO3 (7/75 mol) \(\underrightarrow{t^o}\) 2KCl (7/75 mol) + 3O2\(\uparrow\) (0,14 mol).
b) Số mol khí oxi là 4,48/32=0,14 (mol).
Khối lượng kali clorat cần dùng là 7/75.122,5=343/30 (g).
Khối lượng chất rắn thu được là 7/75.74,5=1043/150 (g).
Đúng 1
Bình luận (0)
\(a,PTHH:2KClO_3\underrightarrow{t^o,MnO_2}2KCl+3O_2\uparrow\\ b,n_{O_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\\ Theo.pt:n_{KClO_3}=\dfrac{2}{3}n_{O_2}=\dfrac{2}{3}.0,2=\dfrac{2}{15}\left(mol\right)\\ m_{KClO_3}=\dfrac{2}{15}.122,5=\dfrac{49}{3}\left(g\right)\)
Đúng 3
Bình luận (0)
| Hóa học 8 - Thanks for your helpingg!!!!!!!!!!!!!~ |
Trong phòng thí nghiệm người ta có thể điều chế oxi bằng cách đốt nóng kali clorat:
2
K
C
l
O
3
(
r
ắ
n
)
→
t
0
2
K
C...
Đọc tiếp
Trong phòng thí nghiệm người ta có thể điều chế oxi bằng cách đốt nóng kali clorat:
2 K C l O 3 ( r ắ n ) → t 0 2 K C l ( r ắ n ) + 3 O 2 ( k h í )
Hãy dùng phương trình hóa học trên nên trả lời những câu hỏi sau:
Muốn điều chế được 4,48 lit khí oxi (đktc) cần dùng bao nhiêu gam K C l O 3 ?