Người ta dùng oxi để đốt cháy hết đơn chất A thì thu được 6,4 gam AO2, biết AO2 có thể tích (đktc) 4,48 lít. Xác định tên nguyên tố A

Những câu hỏi liên quan
Đôt cháy hết 17 gam một hợp chất X thu được 9 gam nước và 11,2 lít khí SO2 (đktc)
a) Tính thể tích khí O2 cần dùng để đốt cháy hết X.
b) X có những nguyên tố nào?
c) Tính tỉ lệ số nguyên tử của mỗi nguyên tố trong hợp chất X
d) Xác định công thức của X. Biết khối lượng mol của X bằng 34 g/mol.
a.
\(n_{SO_2}=\dfrac{11.2}{22.4}=0.5\left(mol\right)\)
Bảo toàn khối lượng :
\(m_{O_2}=9+0.5\cdot64-17=24\left(g\right)\)
b.
X có những nguyên tố : H và S
c.
\(n_{H_2O}=\dfrac{9}{18}=0.5\left(mol\right)\Rightarrow n_H=0.5\cdot2=1\left(mol\right)\)
Số nguyên tử H : Số nguyên tử S = 1 : 0.5 = 2 : 1
d.
Ta có công thức nguyên của X : \(\left(H_2S\right)_n\)
\(M_X=34n=34\left(\dfrac{g}{mol}\right)\)
\(\Rightarrow n=1\)
\(CT:H_2S\)
Đúng 1
Bình luận (0)
Để đốt cháy hoàn toàn một lượng chất hữu cơ A phải dùng vừa hết 3,08 lít
O
2
. Sản phẩm thu được chỉ gồm có 1,80 g
H
2
O
và 2,24 lít
C
O
2
. Các thể tích khí đo ở đktc.1. Xác định công thức đơn giản nhất của A.2. Xác định công thức phân tử của A, biết rằng tỉ khối hơi của A đối với oxi là 2,25.3. Xác định công thức cấu tạo có thể có của chất A, ghi...
Đọc tiếp
Để đốt cháy hoàn toàn một lượng chất hữu cơ A phải dùng vừa hết 3,08 lít O 2 . Sản phẩm thu được chỉ gồm có 1,80 g H 2 O và 2,24 lít C O 2 . Các thể tích khí đo ở đktc.
1. Xác định công thức đơn giản nhất của A.
2. Xác định công thức phân tử của A, biết rằng tỉ khối hơi của A đối với oxi là 2,25.
3. Xác định công thức cấu tạo có thể có của chất A, ghi tên tương ứng, biết rằng A là hợp chất cacbonyl.
1. Theo định luật bảo toàn khối lượng:
m A = m C O 2 + m H 2 O − m O 2
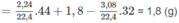
Khối lượng C trong 1,8 g A là: 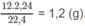
Khối lượng H trong 1,8 g A là: 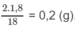
Khối lượng O trong 1,8 g A là : 1,8 - 1,2 - 0,2 = 0,4 (g).
Công thức chất A có dạng C x H y O z :
x : y : z = 0,1 : 0,2 : 0,025 = 4 : 8 : 1
CTĐGN là C 4 H 8 O
2. M A = 2,25.32 = 72 (g/mol)
⇒ CTPT trùng với CTĐGN: C 4 H 8 O .
3. Các hợp chất cacbonyl C 4 H 8 O :
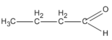 (butanal)
(butanal)
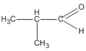 (2-metylpropanal)
(2-metylpropanal)
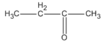 (butan-2-ol)
(butan-2-ol)
Đúng 0
Bình luận (0)
Nung KClO3, người ta thu được KCl và 6,721 khí oxi (đktc).a Viết pt và hoàn thành pthh b tính lượng KCLO3 đã dùng c người ta dùng hết lượng oxi trên để đốt cháy hết đơn chất A thì thu được 13,2g AO2 thea sơ đồ phản ứng A + O2 ---> AO2
a)2KClO3 \(\underrightarrow{t^0}\)2KCl + 3O2
b)n\(_{O_2}\)= 6,72/22,4 = 0,3 mol
theo PTPU ta có: nKClO\(_3\)=(0,3.2):3=0,2 mol
-> mKClO\(_3\)=0,2.122,5=24,5 gam
c) A + O2 -> AO2
Ta có nO\(_2\)= 0,3 mol
Theo PTPU trên ta có: nAO\(_2\) = nO\(_2\)= 0,3 mol
-> MAO\(_2\) = mAO\(_2\)/nAO\(_2\)= 13,2/0,3=44 gam/mol
-> MA + 32 = 44 -> MA= 44-32=12 gam/mol
Vậy A là Cacbon: AO2 là CO2
Đúng 0
Bình luận (2)
C2: Trong phòng thí nghiệm ng` ta điều chế khí oxi cách nung nóng chất hợp chất Kalipemaganat KMnO4 a) Viết PTHH xảy ra b) Để thu đc 4,48 lít oxi (đktc) thì cần khối lượng KMnO4 là bao nhiêu ?C3 Đốt cháy hỗn hợp gồm 0,25 mol Cu;0,09 mol Fe và 0,75 mol Ba trong không khí a) viết PTHH b)tính thể tích oxi(ĐKTC) cần dùng c)Tính khối lượng các sản phẩm tạo thành C4: Oxi cao nhất của môtj nguyên tố R có CTHH là R2Ox. PTK của oxi là 102 . Xác định R và công thức của oxit
Đọc tiếp
C2: Trong phòng thí nghiệm ng` ta điều chế khí oxi = cách nung nóng chất hợp chất Kalipemaganat KMnO4 a) Viết PTHH xảy ra b) Để thu đc 4,48 lít oxi (đktc) thì cần khối lượng KMnO4 là bao nhiêu ?
C3 Đốt cháy hỗn hợp gồm 0,25 mol Cu;0,09 mol Fe và 0,75 mol Ba trong không khí a) viết PTHH b)tính thể tích oxi(ĐKTC) cần dùng c)Tính khối lượng các sản phẩm tạo thành C4: Oxi cao nhất của môtj nguyên tố R có CTHH là R2Ox. PTK của oxi là 102 . Xác định R và công thức của oxit
Để đốt cháy m gam chất A cần dùng 11,2 lít khí oxi thu được 6,72 lít khí CO2 và 7,2 gam nước (các khí ở đktc)
a. Tính m
b. Hợp chất A có những nguyên tố nào ? Giải thích ?
a. Ta có phương trình phản ứng :
A + O2 ---> CO2 + H2O
Áp dụng định luật bảo toàn khối lượng :
mA + mO2 = mCO2 + mH2O
==>mA = mCO2 + mH2O - mO2 = \(\dfrac{6,72}{22,4}\).44+ 7,2 -\(\dfrac{11,2}{22,4}\).32= 4,4 gam
b. Ta thấy khi đốt cháy A thu được CO2 và H2O , theo phương pháp phân tích định tính thì A chứa C và H có thể có Oxi.
nC = nCO2 = 0,3 mol ==> mC = 0,3.12 = 3,6 gam
nH = 2nH2O = 0.8 mol ==> mH = 0,8 .1 = 8 gam
mC + mH = 4,4 gam = mA nên A chỉ chứa nguyên tố Cacbon và Hidro.
Đúng 19
Bình luận (2)
a. Ta có phương trình phản ứng :
A + O2 ---> CO2 + H2O
Áp dụng định luật bảo toàn khối lượng :
mA + mO2 = mCO2 + mH2O
==>mA = mCO2 + mH2O - mO2 = \dfrac{6,72}{22,4}22,46,72.44+ 7,2 -\dfrac{11,2}{22,4}22,411,2.32= 4,4 gam
b. Ta thấy khi đốt cháy A thu được CO2 và H2O , theo phương pháp phân tích định tính thì A chứa C và H có thể có Oxi.
nC = nCO2 = 0,3 mol ==> mC = 0,3.12 = 3,6 gam
nH = 2nH2O = 0.8 mol ==> mH = 0,8 .1 = 8 gam
mC + mH = 4,4 gam = mA nên A chỉ chứa nguyên tố Cacbon và Hidro.
Đúng 5
Bình luận (1)
a. Ta có phương trình phản ứng :
A + O2 ---> CO2 + H2O
Áp dụng định luật bảo toàn khối lượng :
mA + mO2 = mCO2 + mH2O
==>mA = mCO2 + mH2O - mO2 = \dfrac{6,72}{22,4}22,46,72.44+ 7,2 -\dfrac{11,2}{22,4}22,411,2.32= 4,4 gam
b. Ta thấy khi đốt cháy A thu được CO2 và H2O , theo phương pháp phân tích định tính thì A chứa C và H có thể có Oxi.
nC = nCO2 = 0,3 mol ==> mC = 0,3.12 = 3,6 gam
nH = 2nH2O = 0.8 mol ==> mH = 0,8 .1 = 8 gam
mC + mH = 4,4 gam = mA nên A chỉ chứa nguyên tố Cacbon và Hidro.a. Ta có phương trình phản ứng :
A + O2 ---> CO2 + H2O
Áp dụng định luật bảo toàn khối lượng :
mA + mO2 = mCO2 + mH2O
==>mA = mCO2 + mH2O - mO2 = \dfrac{6,72}{22,4}22,46,72.44+ 7,2 -\dfrac{11,2}{22,4}22,411,2.32= 4,4 gam
b. Ta thấy khi đốt cháy A thu được CO2 và H2O , theo phương pháp phân tích định tính thì A chứa C và H có thể có Oxi.
nC = nCO2 = 0,3 mol ==> mC = 0,3.12 = 3,6 gam
nH = 2nH2O = 0.8 mol ==> mH = 0,8 .1 = 8 gam
mC + mH = 4,4 gam = mA nên A chỉ chứa nguyên tố Cacbon và Hidro.a. Ta có phương trình phản ứng :
A + O2 ---> CO2 + H2O
Áp dụng định luật bảo toàn khối lượng :
mA + mO2 = mCO2 + mH2O
==>mA = mCO2 + mH2O - mO2 = \dfrac{6,72}{22,4}22,46,72.44+ 7,2 -\dfrac{11,2}{22,4}22,411,2.32= 4,4 gam
b. Ta thấy khi đốt cháy A thu được CO2 và H2O , theo phương pháp phân tích định tính thì A chứa C và H có thể có Oxi.
nC = nCO2 = 0,3 mol ==> mC = 0,3.12 = 3,6 gam
nH = 2nH2O = 0.8 mol ==> mH = 0,8 .1 = 8 gam
mC + mH = 4,4 gam = mA nên A chỉ chứa nguyên tố Cacbon và Hidro.a. Ta có phương trình phản ứng :
A + O2 ---> CO2 + H2O
Áp dụng định luật bảo toàn khối lượng :
mA + mO2 = mCO2 + mH2O
==>mA = mCO2 + mH2O - mO2 = \dfrac{6,72}{22,4}22,46,72.44+ 7,2 -\dfrac{11,2}{22,4}22,411,2.32= 4,4 gam
b. Ta thấy khi đốt cháy A thu được CO2 và H2O , theo phương pháp phân tích định tính thì A chứa C và H có thể có Oxi.
nC = nCO2 = 0,3 mol ==> mC = 0,3.12 = 3,6 gam
nH = 2nH2O = 0.8 mol ==> mH = 0,8 .1 = 8 gam
mC + mH = 4,4 gam = mA nên A chỉ chứa nguyên tố Cacbon và Hidro.a. Ta có phương trình phản ứng :
A + O2 ---> CO2 + H2O
Áp dụng định luật bảo toàn khối lượng :
mA + mO2 = mCO2 + mH2O
==>mA = mCO2 + mH2O - mO2 = \dfrac{6,72}{22,4}22,46,72.44+ 7,2 -\dfrac{11,2}{22,4}22,411,2.32= 4,4 gam
b. Ta thấy khi đốt cháy A thu được CO2 và H2O , theo phương pháp phân tích định tính thì A chứa C và H có thể có Oxi.
nC = nCO2 = 0,3 mol ==> mC = 0,3.12 = 3,6 gam
nH = 2nH2O = 0.8 mol ==> mH = 0,8 .1 = 8 gam
mC + mH = 4,4 gam = mA nên A chỉ chứa nguyên tố Cacbon và Hidro.
Xong rồi nè bn:)
Đúng 4
Bình luận (0)
Xem thêm câu trả lời
a, Tính thể tích của oxi (đktc) cần dùng để đốt cháy hết 3,1 gam P, biết phản ứng sinh ra chất rắn P2O5.
b, Đốt cháy hoàn toàn 1,12 lít khí CH4 (đktc) cần dùng V lít khí O2 (đktc), sau phản ứng thu được sản phẩm là khí cacbonic (CO2) và nước (H2O). Giá trị của V là
a, Theo giả thiết ta có: \(n_P=\dfrac{3,1}{31}=0,1\left(mol\right)\)
\(4P+5O_2--t^o->2P_2O_5\)
Ta có: \(n_{O_2}=\dfrac{5}{4}.n_P=0,125\left(mol\right)\Rightarrow V_{O_2\left(đktc\right)}=0,125.22,4=2,8\left(l\right)\)
b, Theo giả thiết ta có: \(n_{CH_4}=\dfrac{1,12}{22,4}=0,05\left(mol\right)\)
\(CH_4+2O_2--t^o->CO_2+2H_2O\)
Ta có: \(n_{O_2}=2.n_{CH_4}=0,1\left(mol\right)\Rightarrow V_{O_2\left(đktc\right)}=2,24\left(l\right)\)
Đúng 1
Bình luận (0)
đốt cháy kim loại R trong khi oxi dư , được 3,1 gam oxit hòa tan hoàn toàn oxit của R vào nước thì thu được 4gam đioxit của R
a, xác định tên nguyên tố R , đọc tên oxit hiđroxit của R b, tính thể tích của oxi đã phản ứng ( ở đktc)a, Giả sử R có hóa trị n.
PT: \(R_2O_n+nH_2O\rightarrow2R\left(OH\right)_n\)
Theo ĐLBT KL, có: m oxit + mH2O = m hydroxit
⇒ 3,1 + 18nH2O = 4 ⇒ nH2O = 0,05 (mol)
Theo PT: \(n_{R_2O_n}=\dfrac{1}{n}n_{H_2O}=\dfrac{0,05}{n}\left(mol\right)\)
\(\Rightarrow M_{R_2O_n}=\dfrac{3,1}{\dfrac{0,05}{n}}=62n\) \(\Rightarrow2M_R+16n=62n\Rightarrow M_R=23n\)
Với n = 1 thì MR = 23 (g/mol)
→ R là Natri. Na2O: natri oxit. NaOH: natri hydroxit.
b, PT: \(4Na+O_2\underrightarrow{t^o}2Na_2O\)
Ta có: \(n_{Na_2O}=\dfrac{3,1}{62}=0,05\left(mol\right)\)
Theo PT: \(n_{O_2}=\dfrac{1}{2}n_{Na_2O}=0,025\left(mol\right)\)
\(\Rightarrow V_{O_2}=0,025.22,4=0,56\left(l\right)\)
Đúng 3
Bình luận (0)
1/ Đốt cháy 2,4g đơn chất R trong oxi thì thu được 4,48 lít khí RO2 ( ở đttc).
Xác định tên và KHHH của R và công thức hóa học của oxit .
2/ Xác định tên và KHHH của R, biết ¼ nguyên tử R có khối lượng bằng 1/8 nguyên tử brom..
ghi phần 1 phần 2 rõ ra ạ để em phân biệt
C2: Trong phòng thí nghiệm ng` ta điều chế khí oxi cách nung nóng chất hợp chất Kalipemaganat KMnO4 a) Viết PTHH xảy ra b) Để thu đc 4,48 lít oxi (đktc) thì cần khối lượng KMnO4 là bao nhiêu ?C3 Đốt cháy hỗn hợp gồm 0,25 mol Cu;0,09 mol Fe và 0,75 mol Ba trong không khí a) viết PTHH b)tính thể tích oxi(ĐKTC) cần dùng c)Tính khối lượng các sản phẩm tạo thành C4: Oxi cao nhất của môtj nguyên tố R có CTHH là R2Ox. PTK của oxi là 102 . Xác định R và công thức của oxitKết thúc cuộc trò chuyện
Đọc tiếp
C2: Trong phòng thí nghiệm ng` ta điều chế khí oxi = cách nung nóng chất hợp chất Kalipemaganat KMnO4 a) Viết PTHH xảy ra b) Để thu đc 4,48 lít oxi (đktc) thì cần khối lượng KMnO4 là bao nhiêu ?
C3 Đốt cháy hỗn hợp gồm 0,25 mol Cu;0,09 mol Fe và 0,75 mol Ba trong không khí a) viết PTHH b)tính thể tích oxi(ĐKTC) cần dùng c)Tính khối lượng các sản phẩm tạo thành C4: Oxi cao nhất của môtj nguyên tố R có CTHH là R2Ox. PTK của oxi là 102 . Xác định R và công thức của oxit
Kết thúc cuộc trò chuyện



























