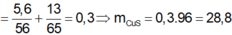Cầu 30: Hòa tan bột nhóm vào dung dịch axit clohidric, thu được 5,34 gam muối khan, hiệu suất phản ứng là 90%. Khôi lượng nhôm cần dùng là ? Giúp em với ạ em đang cần gấp :

Những câu hỏi liên quan
Hòa tan lượng dư bột nhôm vào 180ml dung dịch HCl 1M đến khi phản ứng kết thúc, thu được 1,512 lít khí H2 (đktc). HIệu suất phản ứng là ?
Cầu mong mọi người giúp mình giải câu này với ạ
PTHH: \(2Al+6HCl\rightarrow2AlCl_3+3H_2\uparrow\)
Ta có: \(n_{HCl}=0,18\cdot1=0,18\left(mol\right)\)
\(\Rightarrow n_{H_2\left(LT\right)}=0,09\left(mol\right)\)
\(\Rightarrow H\%=\dfrac{\dfrac{1,512}{22,4}}{0,09}\cdot100\%=75\%\)
Đúng 1
Bình luận (1)
PT: \(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
Ta có: \(n_{HCl}=0,18.1=0,18\left(mol\right)\)
Theo PT: \(n_{H_2\left(LT\right)}=\dfrac{1}{2}n_{HCl}=0,09\left(mol\right)\)
\(\Rightarrow V_{H_2\left(LT\right)}=0,09.22,4=2,016\left(l\right)\)
Mà: VH2 (TT) = 1,512 (l)
\(\Rightarrow H\%=\dfrac{1,512}{2,016}.100\%=75\%\)
Bạn tham khảo nhé!
Đúng 2
Bình luận (1)
7. Hòa tan hoàn toàn một lượng bột sắt Fe vào V ml dung dịch axit clohiđric HCl 2M thu được khí hiđro H2 và dung dịch muối sắt (II) clorua FeCl2. Khối lượng muối FeCl2 tăng 7,1 gam so với khối lượng bột sắt Fe. Giá trị của V ứng với: *
A. 0,1
B. 100
C. 50
D. 90
Em cần gấp ạ
\(Fe+2HCl->FeCl_2+H_2\)
Gọi số mol Fe = x (mol) => Theo phương trình suy ra số mol \(FeCl_2=x\)(mol)
Theo bài ra, khối lượng muối FeCl2 tăng 7.1 gam so với khối lượng Fe
=> 127x - 56x = 7.1
=> x = 0.1 (mol)
Theo phương trình => \(n_{HCl}=2x=0.2mol\)
\(=>V_{HCl}=\frac{0.2}{2}=0.1l=100ml\)=> Đáp án B
Chúc bạn học tốt
Phương trình hóa học phản ứng
Fe + 2HCl ---> FeCl2 + H2
Hệ số các chất 1 : 2 : 1 : 1 (1)
tham gia phản ứng
=> nFe = nFeCl2
mà: mFeCl2 - mFe = 7.1
=> nFeCl2.MFeCl2 - nFe.MFeCl2 = 7.1
=> nFeCl2.127 - nFe.56 = 7.1
=> nFe.127 - nFe.56 = 71
=> nFe = 0,1 (mol) (2)
Lại có : Cmol = \(\frac{n_{H_2SO_4}}{V_{H_2SO_4}}=2\Rightarrow n_{H_2SO_4}=2.V_{H_2SO_4}\)
Từ (1) và (2) => \(n_{H_2SO_4}=0,2\left(\text{mol}\right)\)
=> \(V_{H_2SO_4}=0,1\left(l\right)\)
=> Chọn A
Mình viết nhầm tên Axit , Xin lỗi bạn nha !
Nung 5,6 gam bột sắt và 13 gam kẽm với một lượng dư bột lưu huỳnh, sau phản ứng thu được rắn X. Hòa tan hoàn toàn X trong dung dịch axit clohidric thu được khí Y. Dẫn khí Y vào V lit dung dịch CuSO4 dư, sau phản ứng hoàn toàn thu được m gam kết tủa. Gía trị của m là: A. 9,6 gam B. 19,2 gam C. 18,6 gam D. 28,8 gam
Đọc tiếp
Nung 5,6 gam bột sắt và 13 gam kẽm với một lượng dư bột lưu huỳnh, sau phản ứng thu được rắn X. Hòa tan hoàn toàn X trong dung dịch axit clohidric thu được khí Y. Dẫn khí Y vào V lit dung dịch CuSO4 dư, sau phản ứng hoàn toàn thu được m gam kết tủa. Gía trị của m là:
A. 9,6 gam
B. 19,2 gam
C. 18,6 gam
D. 28,8 gam
Hòa tan hoàn toàn 28 gam kim loại Fe vào dung dịch axit clohidric 10%. a/ Tính khối lượng dung dịch axit HCl 10% cần dùng. b/ Tính khối lượng muối FeCl2 và khối lượng H2 thoát ra. c/ Tính nồng độ % dung dịch muối ZnCl2 sau phản ứng. Cho : Fe = 56 ; Cl = 35,5 ; H = 1, S = 32, O = 16
a) n Fe = 28/56 = 0,5(mol)
$Fe + 2HCl \to FeCl_2 + H_2$
Theo PTHH :
n HCl = 2n Fe = 1(mol)
=> m dd HCl = 1.36,5/10% = 365(gam)
b)
n FeCl2 = n H2 = n Fe = 0,5(mol)
Suy ra :
V H2 = 0,5.22,4 = 11,2(lít)
m FeCl2 = 0,5.127 = 63,5(gam)
c)
Sau phản ứng:
mdd = m Fe + mdd HCl - m H2 = 28 + 365 - 0,5.2 = 392(gam)
=> C% FeCl2 = 63,5/392 .100% = 16,2%
Đúng 1
Bình luận (1)
hòa tan hoàn toàn 2,81 g hỗn hợp gồm fe2o3, mgo, zno, trong 500ml h2so4 0,1M (lượng axit vứa đủ phản ứng) . cô cạn dung dịch sau phản ứng thu được lượng muối khan là bao nhiêu.
giúp giùm em với ạ. sắp thi rồi
Dung` DL BTKL: moxit + mH2SO4 = mmuoi' + mH2O
voi' nH2O = nH2SO4 = 0.5*0.1 = 0.05
--> mmuoi' = 2.81 + 0.05*98 - 0.05*18 = 6.81g
Cach' #: (Fe2O3, MgO, ZnO) ----> (Fe2(SO4)3; MgSO4, ZnSO4)
--> nO = nSO4(2-) = nH2SO4 = 0.05
--> m(Fe, Mg, Zn) = 2.81 - mO = 2.81 - 0.05*16 = 2.01g
mmuoi' = mKL + mSO4(2-) = 2.01 + 0.05*96 = 6.81g
Đúng 0
Bình luận (4)
bảo toàn khối lượng
Ta có nH2SO4=0,05 mol =>n H+=0,1 mol
2H+ + O2- ---> H2O
==>2,81+98.0,05=m+0.05.18 ==> m=6,81(gam)
Đúng 0
Bình luận (3)
Hòa tan 11,53g hỗn hợp gồm Ba , K vào lượng nước dư , sau phản ứng xảy ra hoàn toàn thu được dung dịch và 2,464 lít khí H2 điều kiện tiêu chuẩn . Khối lượng chất tan trong dung dịch là ? Giúp em với ạ , em cần gấp
\(n_{H_2\left(dktc\right)}=\dfrac{V}{22,4}=\dfrac{2,464}{22,4}=0,11\left(mol\right)\)
Đặt \(\left\{{}\begin{matrix}n_{Ba}=a\left(mol\right)\\n_K=b\left(mol\right)\end{matrix}\right.\left(a,b>0\right)\)
\(PTHH:Ba+2H_2O->Ba\left(OH\right)_2+H_2\left(1\right)\)
tỉ lệ 1 ; 2 : 1 : 1
n(mol) a--------->2a----------->a---------->a
\(PTHH:2K+2H_2O->2KOH+H_2\left(2\right)\)
tỉ lệ 2 : 2 : 2 ; 1
n(mol) b---------->b---------->b------------>1/2b
Ta có Hệ phương trình sau
\(\left\{{}\begin{matrix}137a+39b=11,53\\a+\dfrac{1}{2}b=0,11\end{matrix}\right.\\ < =>\left\{{}\begin{matrix}a=0,05\\b=0,12\end{matrix}\right.\\ < =>\left\{{}\begin{matrix}n_{Ba}=0,05\left(mol\right)\\n_K=0,12\left(mol\right)\end{matrix}\right.\)
Theo Phương trình (1) ta có: \(n_{Ba\left(OH\right)_2}=a=0,05\left(mol\right)\\ =>m_{Ba\left(OH\right)_2}=n\cdot M=0,05\cdot171=8,55\left(g\right)\)
Theo phương trình (2) ta có
\(n_{KOH}=b=0,12\left(mol\right)\\ m_{KOH}=n\cdot M=0,12\cdot56=6,72\left(g\right)\\ =>m_{ct}=8,55+6,72=15,27\left(g\right)\)
Đúng 4
Bình luận (1)
Hòa tan hoàn toàn 26 gam kẽm vào dung dịch axit Clohidric a viết phương trình hóa học của phản ứng b tính khối lượng HCl cần dùng c tính thể tích khí hidro ( điều kiện tiêu chuẩn) thu được sau phản ứng
\(n_{Zn}=\dfrac{26}{65}=0.4\left(mol\right)\)
\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
\(0.4.......0.8....................0.4\)
\(m_{HCl}=0.8\cdot36.5=29.2\left(g\right)\)
\(V_{H_2}=0.4\cdot22.4=8.96\left(l\right)\)
Đúng 2
Bình luận (0)
Cho 5.4 gam nhôm phản ứng hoàn toàn với dung dịch axit clohidric 3.65% tạo thành muối nhôm clorua và khí hidro
a)viết PTHH
b)tính thể tích khí hidro thu được
c)tính khối lương muối nhôm clorua tạo thành
d) tính khối lượng dung dịch axit clohidric cần dùng
a)
2Al + 6HCl → 2AlCl3 + 3H2
b) nAl = 5,4 : 27 = 0,2 mol
Theo tỉ lệ phản ứng => nH2 = 0,3 mol <=> VH2 = 0,3.22,4 = 6,72 lít.
c) nAlCl3 = nAl = 0,2 mol
=> mAlCl3 = 0,2. 133,5 = 26,7 gam.
d) nHCl cần dùng = 3nAl = 0,6 mol
=> mHCl = 0,6.36,5 = 21,9 gam
<=> mdd HCl cần dùng = \(\dfrac{21,9}{3,65\%}\) = 600 gam
Đúng 1
Bình luận (0)
Nung nóng 48,12 gam hỗn hợp Al, Al2O3 và Cr2O3 trong khí trơ, sau một thời gian thu được rắn X. Chia X làm hai phần bằng nhau: phần một cho vào dung dịch NaOH loãng dư, thấy lượng NaOH phản ứng là 13,6 gam, đồng thời thu được 7,68 gam rắn. Hòa tan hết hai phần trong dung dịch HCl loãng, đun nóng (dùng dư), thu được 2,464 lít khí H2 (đktc) và dung dịch chưa 61,57 gam muối. Biết rằng trong phản ứng nhiệt nhôm, Cr2O3 chỉ bị khử thành Cr. Hiệu suất phản ứng nhiệt nhôm là: A. 60%. B. 75%. C. 50%....
Đọc tiếp
Nung nóng 48,12 gam hỗn hợp Al, Al2O3 và Cr2O3 trong khí trơ, sau một thời gian thu được rắn X. Chia X làm hai phần bằng nhau: phần một cho vào dung dịch NaOH loãng dư, thấy lượng NaOH phản ứng là 13,6 gam, đồng thời thu được 7,68 gam rắn. Hòa tan hết hai phần trong dung dịch HCl loãng, đun nóng (dùng dư), thu được 2,464 lít khí H2 (đktc) và dung dịch chưa 61,57 gam muối. Biết rằng trong phản ứng nhiệt nhôm, Cr2O3 chỉ bị khử thành Cr. Hiệu suất phản ứng nhiệt nhôm là:
A. 60%.
B. 75%.
C. 50%.
D. 80%.
Khối lượng mỗi phần là 24,06 gam, gồm Al (a), Al2O3 (b) và Cr2O3 (c)
—> 27a + 102b + 152c = 24,06 (1)
nNaOH = a + 2b = 0,34 (2)
2Al + Cr2O3 —> Al2O3 + 2Cr
2x………x………x… ….2x
m rắn = 152(c – x) + 52.2x = 7,68 (3)
nO = 3b + 3c
—> nH2O = 3b + 3c
Bảo toàn H
—> nHCl = 6b + 6c + 0,11.2
—> m muối = 27(a + 2b) + 52.2c + 35,5(6b + 6c + 0,11.2) = 61,57 (4)
(1)(2)(3)(4) —> a = 0,1; b = 0,12; c = 0,06; x = 0,03
—> H = 2x/a = 60%
Đáp án A
Đúng 0
Bình luận (0)