Nguyên tử của nguyên tố nào sau đây có xu hướng đạt cấu hình electron bền vững của khí hiếm argon khi tham gia hình thành liên kết hóa học?
A. Fluorine
B. Oxygen
C. Hydrogen
D. Chlorine
Nguyên tử của nguyên tố nào sau đây có xu hướng đạt cấu hình electron bền vững của khí hiếm argon khi tham gia hình thành liên kết hóa học?
A. Fluorine
B. Oxygen
C. Hydrogen
D. Chlorine
Ion Mg2+ có cấu hình electron giống cấu hình electron của khí hiếm nào?
A. Helium
B. Neon
C. Argon
D. Krypton
Nguyên tử Mg (Z = 12): 1s22s22p63s2
=> Mg2+: 1s22s22p6 => Ion Mg2+ có 10 electron và 2 lớp electron
=> Giống cấu hình electron của nguyên tử khí hiếm Neon
Đáp án B
Khí quyển Trái Đất là lớp các chất khí bao quanh và được giữ lại bởi lực hấp dẫn của Trái Đất. Thành phần khí quyển gồm có nitrogen, oxygen, argon, carbon dioxide, hơi nước và một số chất khí khác (helium, neon, methane, hydrogen,…) Em hãy liệt kê các đơn chất có trong khí quyển. Tìm hiểu và cho biết đơn chất nào được dùng để bơm vào lốp ô tô thay cho không khí
Các đơn chất có trong khí quyển: nitrogen, oxygen, argon, helium, neon, hydrogen,…
Chất được dùng để bơm vào lốp ô tô thay cho không khí là khí nitrogen
Ở những nơi có điều kiện, người ta bơm khí nitrogen vào lốp xe ô tô thay cho không khí vì một số ưu điểm sau:
- Ít bị rò rỉ: Không khí thoát ra khỏi lốp thông qua cấu trúc phân tử của cao su bị kéo giãn khi bánh xe lăn. Nguyên tử nitrogen to hơn so với oxygen, vì vậy ít bị rỉ không khí ra khỏi cao su khiến lốp "non hơi".
- Tiết kiệm nhiên liệu hơn: Vì nitrogen lưu giữ lại trong lốp xe lâu hơn nên giữ áp suất, và giúp tiết kiệm nhiên liệu.
- Giúp điều khiển xe tốt hơn: Áp suât lốp được cần bằng giúp điều khiển xe dễ dàng hơn.
- Giảm hao mòn: Không khí thông thường sẽ chứa hơi nước làm rỉ sét bên trong bánh xe hoặc thân van, khi bơm nitrogen sẽ giảm thiểu được điều này.
Trong tự nhiên, chỉ có các khí hiếm tồn tại ở dạng đơn nguyên tử bền vững, còn nguyên tử của các nguyên tố khác thường có xu hướng kết hợp với nhau bằng các liên kết hóa học. Các liên kết hóa học được hình thành như thế nào?
Liên kết ion:
`-` Liên kết ion được hình thành bởi lực hút giữa `2` ion trái dấu `(` Kim loại `-` Phi kim`)`.
Liên kết cộng hóa trị:
`-` Liên kết cộng hóa trị được hình thành giữa `2` nguyên tử bằng một hay nhiều cặp electron dùng chung.
đề bài :" một nguyên tử R có tổng số hạt là 34, trong đó số hạt mang điện gấp 1,833 lần số hạt không mang điện.
a) tìm số hạt p,e,n và số khối của nguyên tử R
b)viết cấu hình electron của R theo 4 cách.
c) xác định loại nguyên tố R, giải thích?
d)nguyên tố R là nguyên tố kim loại, phi kim, hay khí hiếm giải thích?
e) để đạt cấu hình e bền của khí hiếm R có khuynh hướng cho hay nhận e, viết cấu hình e của ion mà r có thể tạo thành
ta co p+n+e =34
ma P=E suy ra 2p +n =34
2p =1,833 +n
p<n<1,5p
suy ra 3p<2p+n<3,5p
3p<34<3,5p
34:3,5<p<34:3
=9,7<p<11,3
thu p=10 va 11 ta thay 11 hop li nen chon p=11=e
r la na va la nguyen to kim loai vi co 1e lop ngoai cung
Trong điều kiện thường, nguyên tử của các nguyên tố khí hiếm tồn tại độc lập vì có lớp electron ngoài cùng bền vững. Nguyên tử của các nguyên tố khác luôn có xu hướng tham gia liên kết để có được lớp electron ngoài cùng bền vững tương tự khí hiếm. Vậy liên kết giữa các nguyên tử được hình thành như thế nào?

Lớp vỏ ngoài cùng của các nguyên tử khí hiếm có 8 electron (riêng He có 2 electron) là lớp vỏ bền vững. Vì vậy, các nguyên tử khí hiếm tồn tại độc lập trong điều kiện thường.
Tại sao vỏ nguyên tử khí hiếm lại đặc biệt?
A. Vì vỏ nguyên tử khí hiếm có 8 electron ở lớp ngoài cùng ( trừ helium là 2 electron ).
B. Vì vỏ nguyên tử khí hiếm không liên kết được.
C. Vì mỗi vỏ nguyên tử của các nguyên tử có tối đa 8 electron ở lớp ngoài cùng ( trừ lớp ngoài cùng của các nguyên tử thuộc chu kì 1 trong bảng tuần hoàn có tối đa 2 electron ).
D. Tất cả đều đúng.
Viết cấu hình electron nguyên tử của các nguyên tố sau đây : Al, Mg, Na, Ne. Từ các cấu hình đó hãy cho biết các nguyên tử Al, Mg, Na, mỗi nguyên tử nhường mấy electron thì có cấu hình electron giống như của khí hiếm Ne.
Hãy cho biết tại sao các nguyên tử kim loại lại có khuynh hướng nhường electron để trở thành các ion dương ?
Cấu hình electron của Al, Mg, Na, Ne :
Al 1 s 2 2 s 2 2 p 6 3 s 2 3 p 1 |
Mg 1 s 2 2 s 2 2 p 6 3 s 2 |
Na 1 s 2 2 s 2 2 p 6 3 s 1 |
Ne 1 s 2 2 s 2 2 p 6 |
Từ các cấu hình trên ta dễ dàng thấy rằng nếu :
nguyên tử Na nhường le để trở thành ion Na + ;
nguyên tử Mg nhường 2e để trở thành ion Mg 2 + ;
nguyên tử Al nhường 3e để trở thành ion Al 3 + ,
thì các ion được hình thành có cấu hình electron giống cấu hình electron của khí hiếm Ne với 8 electron ở lớp ngoài cùng.
Ta đã biết cấu hình electron của các khí hiếm với 8 electron (đối với He là electron) ở lớp ngoài cùng là một cấu hình electron vững bền. Vì vậy, các nguyên tử kim loại có khuynh hướng dễ nhường electron để có cấu hình electron vững bền của khí hiếm đứng trước.
Phân loại chất
Mô hình hạt của đồng ở thể rắn, khí oxygen, khí hiếm helium, khí carbon dioxide và muối ăn ở thể rắn được biểu diễn trong Hình 5.1
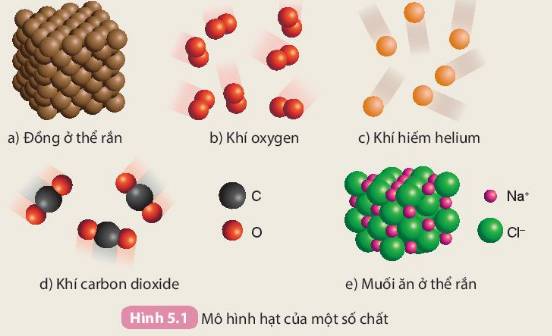
Lưu ý: Nguyên tử được biểu diễn bằng các quả cầu. Các nguyên tử cùng màu thuộc cùng một nguyên tố hóa học, các nguyên tử khác màu thuộc các nguyên tố hóa học khác nhau.
Quan sát các mô hình trong Hình 5.1, thảo luận nhóm và thực hiện yêu cầu sau:
Dựa vào thành phần nguyên tố, em hãy phân loại các chất trên thành 2 loại: chất được tạo nên từ một nguyên tố hóa học và chất được tạo nên từ hai nguyên tố hóa học.
Chất được tạo nên từ `1` nguyên tố hóa học:
`Fe, O, He`
Chất được tạo nên từ `2` nguyên tố hóa học:
Carbondioxide, `NaCl (` muối ăn `)`
Hãy viết cấu hình electron nguyên tử của các nguyên tố sau đây : O, F, Ne. Từ các cấu hình đó hãy cho biết các nguyên tử O, F, mỗi nguyên tử nhận thêm mấy electron thì có cấu hình electron giống như của khí hiếm Ne đứng sau.
Hãy cho biết tại sao các nguyên tử phi kim lại có khuynh hướng nhận thêm electron để trở thành các ion âm ?
O: 1 s 2 2 s 2 2 p 4
F: 1 s 2 2 s 2 2 p 5
Ne: 1 s 2 2 s 2 2 p 6
Từ các cấu hình trên ta dễ dàng thấy rằng nếu nguyên tử F nhận thêm 1e để trở thành ion F - , nguyên tử O nhận thêm 2e để trở thành ion O 2 - thì các ion được hình thành có cấu hình electron giống cấu hình electron của khí hiếm Ne với 8 electron ở lớp ngoài cùng.
Như ta đã biết, cấu hình electron của các khí hiếm với 8 electron (đối với He là 2 electron) ở lớp ngoài cùng là một cấu hình electron vững bền (năng lượng thấp). Vì vậy, các nguyên tử phi kim có khuynh hướng nhận electron để có cấu hình electron vững bền của khí hiếm đứng sau.