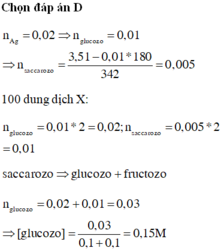cho 100 ml dung dịch có chứa 4,44 g CaCl2 vào 50 ml dung dịch có chứa 3,4 gam AgNO3 tính nồng độ mol của các chất trong dung dịch sau phản ứng cho rằng thể tích dung dịch thay đổi không đáng kể

Những câu hỏi liên quan
Trộn 30 ml dung dịch có chứa 44,4 gam CaCl2 với 70 ml dung dịch AgNO3 vừa đủ.
a/ Tính khối lượng chất rắn sinh ra.
b/ Tính nồng độ mol của chấ còn lại trong dung dịch sau phản ứng. Cho rằng thể tích dung dịch thay đổi
không đáng kể.
Trộn 30 ml dung dịch có chứa 2,22 gam CaCl2 với 70 ml dung dịch có chứa 1,7 gam AgNO3
a, Hãy cho biết hiện tượng quan sát được và viết PTHH xảy ra
b, Tính khối lượng kết tủa sinh ra
c, Tính nồng độ mol / lít của chất còn lại trong dung dịch sau phản ứng
Biết rằng thể tích dung dịch thay đổi không đáng kể
a) dung dịch xuất hiện kết tủa trắng ( AgCl )
CaCl2 + 2AgNO3 --> Ca(NO3)2 + 2AgCl
b)
CaCl2 + 2AgNO3 --> Ca(NO3)2 + 2AgCl
Tpu 0.02 0.01
Pu 0.005 0.01 0.01 0.02
Spu 0.015 0.01 0.02
n CaCl2= m/M= 2.22/ 111= 0.02 (mol)
n AgNO3= 1.7 / 170= 0.01 (mol)
Ta có: 0.02/ 1 > 0.01/ 2 => CaCl2 dư, AgNO3 hết
m AgCl = 0.02 * 143.5 = 2.87 (g) => m kết tủa = 2.87 g
c) Tổng thể tích 2 dung dịch là:
V = 0.03 + 0.07= 0.1 ( lít )
Nồng độ mol của dung dịch CaCl dư:
CM ( CaCl2 ) = 0.015/ 0.1 = 0.15 M
Nồng độ mol của dung dịch Ca(NO3) tạo thành sau phản ứng là:
CM [ Ca(NO3)2 ] = 0.01/ 0.1 = 0.1 M
Đúng 0
Bình luận (0)
Hòa tan 100 ml dung dịch có chứa 27 g CuCl2 vào 100 ml dung dịch có chứa 12 g NaOH a hãy nêu hiện tượng của phản ứng Tính khối lượng của chất rắn tạo thành B Tính nồng độ mol của dung dịch sau phản ứng biết rằng thể tích thay đổi không thay đổi đáng kể
Cho 5,4 gam Al vào 100 ml dung dịch H 2 SO 4 0,5M. Tính nồng độ mol của các chất trong dung dịch sau phản ứng. Cho ràng thể tích dung dịch sau phản ứng thay đổi không đáng kể.
n Al 2 SO 4 3 = 0,05/3 x 1 ≈ 0,017 mol
C M Al 2 SO 4 3 = 0,017/0,1 = 0,17M
Đúng 0
Bình luận (0)
Hòa tan 400 ml dung dịch kcl 2m vào 100 ml dung dịch AgNO3 2 m a hãy nêu hiện tượng của phản ứng Tính khối lượng của chất rắn tạo thành B Tính nồng độ mol của dung dịch sau phản ứng biết rằng thể tích thay đổi không thay đổi đáng kể
a, Hiện tượng: có kết tủa trắng.
\(n_{KCl}=0,4\cdot2=0,8\left(mol\right);n_{AgNO_3}=2\cdot0,1=0,2\left(mol\right)\\ PTHH:KCl+AgNO_3\rightarrow KNO_3+AgCl\downarrow\\ ....0,2....0,2.....0,2....0,2\left(mol\right)\)
Vì \(\dfrac{n_{KCl}}{1}>\dfrac{n_{AgNO_3}}{1}\) nên sau phản ứng KCl dư, tính theo AgNO3
\(\Rightarrow m_{AgCl}=0,2\cdot143,5=28,7\left(g\right)\)
\(b,V_{dd\left(sau.p/ứ\right)}=V_{KNO_3}=V_{KCl}+V_{AgNO_3}=0,4+0,1=0,5\left(l\right)\\ \Rightarrow C_{M_{KNO_3}}=\dfrac{0,2}{0,5}=0,4M\)
Đúng 1
Bình luận (0)
Cho 50 ml dung dịch X chứa 3,51 gam hỗn hợp saccarozơ và glucozơ phản ứng với lượng dư
A
g
N
O
3
trong dung dịch
N
H
3
, thu được 2,16 gam
A
g
. Đun nóng 100 ml dung dịch X với 100 ml dung dịch
H
2
S
O
4
0,05M cho đến khi phản ứng hoàn toàn thu được dung dịch Y, giả...
Đọc tiếp
Cho 50 ml dung dịch X chứa 3,51 gam hỗn hợp saccarozơ và glucozơ phản ứng với lượng dư A g N O 3 trong dung dịch N H 3 , thu được 2,16 gam A g . Đun nóng 100 ml dung dịch X với 100 ml dung dịch H 2 S O 4 0,05M cho đến khi phản ứng hoàn toàn thu được dung dịch Y, giả thiết thể tích dung dịch không thay đổi. Nồng độ mol của glucozơ có trong dung dịch Y là ?
A. 0,10M
B. 0,25M
C. 0,20M
D. 0,15M
1. Lấy 150 ml dung dịch CaCl, tác dụng vừa đủ với 50 ml dung dịch AgNO3, sau phản ứng thu được 28,7 gam kết tủa và dung dịch X. Giả sử thể tích dung dịch sau phản ứng thay đổi không đáng kể thì nồng độ mol/lit của chất tan trong dung dịch X bằng?2. Một cốc chứa 500 ml nước và lá nhôm khối lượng 5,4 gam, cho thêm vào cốc 2,3 gam kim loại natri. Sau khi kết thúc phản ứng, thu được V lít khí (đktc), dung dịch X có chứa m gam chất tan và một lượng chất rắn chưa tan. Giá trị của V và m lần lượt?
Đọc tiếp
1. Lấy 150 ml dung dịch CaCl, tác dụng vừa đủ với 50 ml dung dịch AgNO3, sau phản ứng thu được 28,7 gam kết tủa và dung dịch X. Giả sử thể tích dung dịch sau phản ứng thay đổi không đáng kể thì nồng độ mol/lit của chất tan trong dung dịch X bằng?
2. Một cốc chứa 500 ml nước và lá nhôm khối lượng 5,4 gam, cho thêm vào cốc 2,3 gam kim loại natri. Sau khi kết thúc phản ứng, thu được V lít khí (đktc), dung dịch X có chứa m gam chất tan và một lượng chất rắn chưa tan. Giá trị của V và m lần lượt?
1. \(CaCl_2+2AgNO_3\rightarrow Ca\left(NO_3\right)_2+2AgCl_{\downarrow}\)
\(n_{AgCl}=\dfrac{28,7}{143,5}=0,2\left(mol\right)\)
Theo PT: \(n_{Ca\left(NO_3\right)_2}=\dfrac{1}{2}n_{AgCl}=0,1\left(mol\right)\)
\(\Rightarrow C_{M_{Ca\left(NO_3\right)_2}}=\dfrac{0,1}{0,15+0,05}=0,5\left(M\right)\)
Đúng 2
Bình luận (0)
2. \(n_{Na}=\dfrac{2,3}{23}=0,1\left(mol\right)\)
BTNT Na, có: nNaOH = nNa = 0,1 (mol)
\(n_{Al}=\dfrac{5,4}{27}=0,2\left(mol\right)\)
\(2Al+2NaOH+2H_2O\rightarrow2NaAlO_2+3H_2\)
Xét tỉ lệ \(\dfrac{0,2}{2}>\dfrac{0,1}{2}\), ta được Al dư.
Theo PT: \(n_{H_2}=\dfrac{3}{2}n_{NaOH}=0,15\left(mol\right)\Rightarrow V_{H_2}=0,15.22,4=3,36\left(l\right)\)
\(n_{Al\left(pư\right)}=n_{NaOH}=0,1\left(mol\right)\Rightarrow n_{Al\left(dư\right)}=0,2-0,1=0,1\left(mol\right)\)
\(\Rightarrow m_{Al\left(dư\right)}=0,1.27=2,7\left(g\right)\)
Đúng 2
Bình luận (0)
Cho 24 gam fe2 o3 vào 200 ml dung dịch h2so4 2,5M a, hãy tính số mol các chất đã cho trước phản ứng B, tính số mol chất còn dư ( nếu có) sau phản ứng C, tính nồng độ mol của dung dịch sau phản ứng biết thể tích dung dịch thay đổi không đáng kể
a) $n_{Fe_2O_3} = \dfrac{24}{160} = 0,15(mol)$
$n_{H_2SO_4} =0,2.2,5 = 0,5(mol)$
b)
$Fe_2O_3 + 3H_2SO_4 \to Fe_2(SO_4)_3 + 3H_2O$
Vì :
$n_{Fe_2O_3} : 1 < n_{H_2SO_4} : 3$ nên $H_2SO_4$ dư
$n_{H_2SO_4\ pư} = 3n_{Fe_2O_3} = 0,45(mol)$
$n_{H_2SO_4\ dư} = 0,5 - 0,45 = 0,05(mol)$
c)
$n_{Fe_2(SO_4)_3} = n_{Fe_2O_3} = 0,15(mol)$
$C_{M_{Fe_2(SO_4)_3}} = \dfrac{0,15}{0,2} = 0,75M$
$C_{M_{H_2SO_4}} = \dfrac{0,05}{0,2} = 0,25M$
Đúng 2
Bình luận (0)
Hoà tan 40g MgO vào 500 ml dung dịch HCl 1M Tính nồng độ mol của các chất có trong dung dịch thu được sau phản ứng Giả sử thể tích của dung dịch thay đổi không đáng kể
Xem chi tiết
Ta có: \(n_{MgO}=\dfrac{40}{40}=1\left(mol\right)\)
\(n_{HCl}=0,5.1=0,5\left(mol\right)\)
PT: \(MgO+2HCl\rightarrow MgCl_2+H_2O\)
Xét tỉ lệ: \(\dfrac{1}{1}< \dfrac{0,5}{2}\), ta được MgO dư.
Theo PT: \(n_{MgCl_2}=\dfrac{1}{2}n_{HCl}=0,25\left(mol\right)\)
\(\Rightarrow C_{M_{MgCl_2}}=\dfrac{0,25}{0,5}=0,5\left(M\right)\)
Đúng 4
Bình luận (0)
Cho 500 ml dung dịch calcium hydroxide Ca(OH)2 0,01M vào 200 ml dung dịch hydrochloric acid HCI 0,01M a) Tính nồng độ mol các chất trong dung dịch sau phản ứng. Biết thể tích dung dịch sau phản ứng thay đổi không đáng kể. b) Cho biết hiện tượng xảy ra khi nhúng giấy quỳ tím vào dung dịch sau phản ứng, giải thích hiện tượng.
a, Ta có: \(n_{Ca\left(OH\right)_2}=0,5.0,01=0,005\left(mol\right)\)
\(n_{HCl}=0,2.0,01=0,002\left(mol\right)\)
PT: \(Ca\left(OH\right)_2+2HCl\rightarrow CaCl_2+2H_2O\)
Xét tỉ lệ: \(\dfrac{0,005}{1}>\dfrac{0,002}{2}\), ta được Ca(OH)2 dư.
Theo PT: \(n_{Ca\left(OH\right)_2\left(pư\right)}=n_{CaCl_2}=\dfrac{1}{2}n_{HCl}=0,001\left(mol\right)\)
\(\Rightarrow n_{Ca\left(OH\right)_2\left(dư\right)}=0,005-0,001=0,004\left(mol\right)\)
\(\Rightarrow\left\{{}\begin{matrix}C_{M_{CaCl_2}}=\dfrac{0,001}{0,5+0,2}=\dfrac{1}{700}\left(M\right)\\C_{M_{Ca\left(OH\right)_2}}=\dfrac{0,004}{0,5+0,2}=\dfrac{1}{175}\left(M\right)\end{matrix}\right.\)
b, - Quỳ tím hóa xanh do Ca(OH)2 dư.
Đúng 1
Bình luận (0)
\(a)n_{Ca\left(OH\right)_2}=0,5.0,01=0,005mol\\ n_{HCl}=0,2.0,01=0,002mol\\ Ca\left(OH\right)_2+2HCl\rightarrow CaCl_2+2H_2O\)
\(\Rightarrow\dfrac{0,005}{1}>\dfrac{0,002}{2}\Rightarrow Ca\left(OH\right)_2.dư\)
\(Ca\left(OH\right)_2+2HCl\rightarrow CaCl_2+2H_2O\)
0,001 0,002 0,001 0,001
\(C_M\) \(_{CaCl_2}=\dfrac{0,001}{0,5+0,2}=\dfrac{1}{700}M\)
\(C_M\) \(_{Ca\left(OH\right)_2}=\dfrac{0,005-0,001}{0,5+0,2}=\dfrac{1}{175}M\)
b) Hiện tượng: quỳ tím hoá xanh vì trong phản ứng \(Ca\left(OH\right)_2\) dư nên dung dịch sau phản ứng có tính kiềm nên quỳ tím hoad xanh.
Đúng 1
Bình luận (0)




![Lớp 9/2 [THCS SƠN KIÊN]...](https://hoc24.vn/images/avt/avt109617058_256by256.jpg)