Đốt cháy 1,3 g bột nhôm trong khí clo người ta thu được 6,675g hợp chất nhôm clorua. Giả sử chưa biết hóa trị của Al và Cl
a, Tìm CTHH của nhôm clorua
b, Tính khối lượng của khí clo tác dụng với nhôm
11/ Đốt nóng 1,35 g bột nhôm trong khí Clo thu được 6,675g Nhôm Clorua cho biết :
a) Công thức đơn giản của Nhôm Clorua ( giả sử chưa biết hóa trị của Al và Cl )
b) Viết PTHH của phản ứng và tính thể tích khí Clo ( đktc) đã tham gia phản ứng với Al .
\(PTHH:2Al+3Cl_2\) → \(2AlCl_3\)
\(n_{Al}=\dfrac{m}{M}=\dfrac{1,35}{27}=0,05\left(mol\right)\)
Theo PTHH
⇒ \(n_{Cl_2}=\dfrac{3}{2}n_{Al}=\dfrac{3}{2}.0,05=0,075\left(mol\right)\)
⇒ \(V_{Cl_2\left(đktc\right)}=n.22,4=0,075.22,4=1,68\left(l\right)\)
Đốt nóng 1,35g bột nhôm trong khi clo, người ta thu được 6,675g nhôm clorua. Em hãy cho biết: Phương trình hóa học của nhôm tác dụng với khí clo.
Phương trình hóa học: 2 A l + 3 C l 2 → 2 A l C l 3
Đốt nóng 1,35g bột nhôm trong khi clo, người ta thu được 6,675g nhôm clorua. Em hãy cho biết: Công thức hóa học đơn giản của nhôm clorua, giải sử rằng ta chưa biết hóa trị của nhôm và clo.
m C l = m A l C l 3 - m A l = 6,675 - 1,35 = 5,325 g
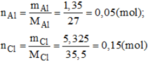
n C l = 3 . n A l ⇒ số nguyên tử Cl gấp 3 số nguyên tử Al. Công thức hóa học đơn giản của nhôm clorua: A l C l 3
Giải giúp mik vs aj
Đốt cháy 1,3g bột nhôm trong khí Clo người ta thu được 6,675g .hợp chất nhôm clorua.
Giả sử chưa biết hoá trị của Al và Cl .
a) Tìm CTHH của nhôm clorua ?
b) Tính khối lượng của khí clo tác dụng vứi nhôm ?
mCl=6,675-1,3=5,375(g)
=>nCl=5,375/35,5~0,15(mol)
nAl=1,3/27~0,05(mol)
nCl:nAl=3:1
=>CT: AlCl3
Đốt nóng 1,35g bột nhôm trong khi clo, người ta thu được 6,675g nhôm clorua. Em hãy cho biết: Thể tích khí clo (đktc) đã tham gia phản ứng với nhôm.
Câu 2: Đốt nóng bột nhôm trong khí clo, người ta thu được 13,35g nhôm clorua AlCl3.
a/ Viết PTHH của phản ứng
b/ Tính thể tích khí clo cần dùng.
c/ Tính khối lượng bột nhôm tham gia phản ứng.
a) 2Al + 3Cl2 --to--> 2AlCl3
b) \(n_{AlCl_3}=\dfrac{13,35}{133,5}=0,1\left(mol\right)\)
PTHH: 2Al + 3Cl2 --to--> 2AlCl3
0,1<-0,15<---------0,1
=> VCl2 = 0,15.22,4 = 3,36(l)
c) mAl = 0,1.27 = 2,7(g)
\(a.PTHH:2Al+3Cl_2\overset{t^o}{--->}2AlCl_3\)
b. Ta có: \(n_{AlCl_3}=\dfrac{13,35}{133,5}=0,1\left(mol\right)\)
Theo PT: \(n_{Cl_2}=\dfrac{3}{2}.n_{AlCl_3}=\dfrac{3}{2}.0,1=0,15\left(mol\right)\)
\(\Rightarrow V_{Cl_2}=0,15.22,4=3,36\left(lít\right)\)
c. Theo PT: \(n_{Al}=n_{AlCl_3}=0,1\left(mol\right)\)
\(\Rightarrow m_{Al}=0,1.27=2,7\left(g\right)\)
Đốt cháy hết 1,08 gam bột Nhôm trong bình chứa khí Clo ,sau khi nhôm cháy vừa hết với lượng Clo có trong bình thì thu được a gam Nhôm clorua.
a)Tính thể tích khí Clo đã tham gia phản ứng đó ở đktc
b)tính giá trị a theo 2 cách
\(n_{Al}=\frac{1,08}{27}=0,04mol\)
\(2Al+3Cl_2\rightarrow^{t^o}2AlCl_3\)
a) \(n_{Cl_2}=\frac{3}{2}.0,04=0,06mol\)
\(V_{Cl_2}=0,06.22,4=1,344l\)
b) Cách 1: \(m_{AlCl_3}=m_{Al}+m_{Cl_2}=1,08+71.0,06=5,34g\)
Cách 2: \(n_{AlCl_3}=n_{Al}=0,04mol\)
\(m_{AlCl_3}=0,04.133,5=5,34g\)
cho 2,7g nhôm tác dụng với khí Clo thu được muối nhôm Clorua.
a) Lập pt hóa học.
b) tính thể tích điều kiện xác định.
c) tính khối lượng của muối tạo thành.
nAl = 2,7/27 = 0,1 (mol)
PTHH: 2Al + 3Cl2 -> (t°) 2AlCl3
Mol: 0,1 ---> 0,15 ---> 0,1
VCl2 = 0,15 . 22,4 = 3,36 (l)
mAlCl3 = 0,1 . 133,5 = 13,35 (g)
a/
2Al+3Cl2 --(t^o)--> 2AlCl3
\(nAl=\dfrac{2,7}{27}=0,1\left(mol\right)\)
=> \(nCl_2=\dfrac{3}{2}.0,1=0,15\left(mol\right)\)
\(VCl_2=0,15.22,4=3,36\left(lít\right)\)
c, \(nAlCl_3=nAl=0,1\left(mol\right)\)
\(mAlCl_3=0,1.133,5=13,35\left(g\right)\)
Cho 5,4 gam nhôm (Al) tác dụng với axit clohiđric (HCl) tạo thành khí hiđro và muối nhôm clorua (AlCl3). a. Tính thể tích khí hiđro thu được (đktc) ? b. Tính khối lượng muối nhôm clorua tạo thành ? (biết Al = 27; Cl = 35,5; H = 1)
\(n_{Al}=\dfrac{m_{Al}}{M_{Al}}=\dfrac{5,4}{27}=0,2mol\)
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
0,2 0,2 0,3 ( mol )
\(V_{H_2}=n_{H_2}.22,4=0,3.22,4=6,72l\)
\(m_{AlCl_3}=n_{AlCl_3}.M_{AlCl_3}=0,2.133,5=26,7g\)