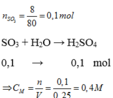Cho 16g SO3 vào nước ta thu được 400ml dung dịch H2SO4. Tín nồng độ mol/lit của dung dịch thu được.

Những câu hỏi liên quan
a: hòa tan hoàn toàn 0,3 mol NaOH vào nước thu được 0,5 lít dung dịch NaOH. tính nồng độ mol của dung dịch?
b: hòa tan hoàn tàn 24 gam NaOH vào nước thu được 400ml dung dịch NaOH. tính nồng độ mol của dung dịch?
\(a,C_{M\left(NaOH\right)}=\dfrac{0,3}{0,5}=0,6M\\ b,n_{NaOH}=\dfrac{24}{40}=0,6\left(mol\right)\\ C_{M\left(NaOH\right)}=\dfrac{0,6}{0,4}=1,5M\)
Đúng 1
Bình luận (0)
Bài 5. Cho 100ml dung dịch H2SO4 2M tác dụng với 400ml dung dịch NaOH 1,5M thu được dung dịch A. Tính nồng độ mol các chất tan trong dung dịch A.Bài 6. Cho 100ml dung dịch H2SO4 2M tác dụng với 400ml dung dịch NaOH 1,5M ta thu được dung dịch A. Tính nồng độ mol các chất trong dung dịch A.Bài 7. Trộn 300ml dung dịch Ba(OH)2 1M với 200ml dung dịch H2SO4 1M ta thu được dung dịch A và mg kết tủa. Tính giá trị của m và nồng độ mol các chất trong dd A.Bài 8. Trộn 200ml dung dịch Na2CO3 với 300ml dung...
Đọc tiếp
Bài 5. Cho 100ml dung dịch H2SO4 2M tác dụng với 400ml dung dịch NaOH 1,5M thu được dung dịch A. Tính nồng độ mol các chất tan trong dung dịch A.
Bài 6. Cho 100ml dung dịch H2SO4 2M tác dụng với 400ml dung dịch NaOH 1,5M ta thu được dung dịch A. Tính nồng độ mol các chất trong dung dịch A.
Bài 7. Trộn 300ml dung dịch Ba(OH)2 1M với 200ml dung dịch H2SO4 1M ta thu được dung dịch A và mg kết tủa. Tính giá trị của m và nồng độ mol các chất trong dd A.
Bài 8. Trộn 200ml dung dịch Na2CO3 với 300ml dung dịch HCl 1M ta thu được dung dịch A và V lít khí CO2 ở đktc. Tính V và nồng độ mol các chất trong dung dịch A.
các bạn giúp mình với ạ
Hòa tan 12,4 gam Na2O vào nước thu được 400ml dung dịch. Nồng độ mol của dung dịch thu được là bao nhiêu
\(n_{Na_2O}=\dfrac{12,4}{62}=0,2\left(mol\right)\\ Na_2O+H_2O\rightarrow2NaOH\\ n_{NaOH}=0,2.2=0,4\left(mol\right)\\ C_{MddNaOH}=\dfrac{0,4}{0,4}=1\left(M\right)\)
Đúng 3
Bình luận (0)
\(n_{Na_2O}=\dfrac{12,4}{62}=0,2mol\\ Na_2O+H_2O\rightarrow2NaOH\\ n_{NaOH}=0,2.2=0,4mol\\ C_{M_{NaOH}}=\dfrac{0,4}{0,4}=1M\)
Đúng 2
Bình luận (0)
Cho 2,24 lít khí SO3 (đktc) hòa tan vào nước thu được 500ml dung dịch axit sunfuric(H2SO4)
a) Tính nồng độ mol của dung dịch axit H2SO4.
b)Tính khối lượng Zn có thể phản ứng hết với axit có trong dung dịch trên?
a, PTPƯ: SO3 + H2O ---> H2SO4
nSO3=\(\dfrac{2,24}{22,4}=0,1mol\)
1 mol SO3 ---> 0,1 mol H2SO4
nên 0,1 mol SO3 ---> 0,1 mol H2SO4
CM H2SO4=\(\dfrac{0,1}{0,5}\)=0,2 M
b, PTPƯ: Zn + H2SO4 ---> ZnSO4 + H2
1 mol H2SO4 ---> 1 mol Zn
nên 0,1 mol H2SO4 ---> 0,1 mol Zn
mZn=0,1.65=6,5 g
Đúng 1
Bình luận (0)
Hòa tan 12 gam SO3 vào 100g nước để được dung dịch H2SO4. Tính nồng độ phần trăm của dung dịch H2SO4 thu được
\(SO_3+H_2O\rightarrow H_2SO_4\)
\(n_{SO_3}=\dfrac{12}{80}=0,15\left(mol\right)\)
Theo PT: \(n_{H_2SO_4}=n_{SO_3}=0,15\left(mol\right)\)
\(\Rightarrow C\%_{H_2SO_4}=\dfrac{0,15.98}{12+100}.100\%=13,125\%\)
Đúng 1
Bình luận (0)
Tính nồng độ mol của các ion trong dung dịch thu được khi hòa tan 1,74 gam K2SO4 vào nước được 400ml dung dịch
\(n_{K_2SO_4}=\dfrac{1,74}{174}=0,01\left(mol\right)\)
\(\Rightarrow C_{M\left(K_2SO_4\right)}=\dfrac{0,01}{0,4}=0,025M\)
Phương trình điện li: \(K_2SO_4\rightarrow2K^++SO_4^{2-}\)
\(\Rightarrow\left[K^+\right]=2C_{M\left(K_2SO_4\right)}=0,05M\)
\(\left[SO_4^{2+}\right]=C_{M\left(K_2SO_4\right)}=0,025M\)
Đúng 2
Bình luận (0)
cho 20gam so3 hoà tan vào nước thu được 500ml dung dịch axit h2so4 sau đó cho mg phản ứng hết với axit vừa tạo thành
a) tính nồng độ mol của dung dịch .
b) tính khối lượng mg phản ứng .
\(n_{SO_3}=\dfrac{20}{80}=0,25\left(mol\right)\\ PTHH:SO_3+H_2O\rightarrow H_2SO_4\\ Mol:0,25\rightarrow0,25\rightarrow0,25\\ C_{MH_2SO_4}=\dfrac{0,25}{0,5}=0,5M\\ Mg+H_2SO_4\rightarrow MgSO_4+H_2\uparrow\\ Mol:0,25\leftarrow0,25\\ m_{Mg}=0,25.24=6\left(g\right)\)
Đúng 3
Bình luận (1)
Bài 1: Cần thêm bao nhiêu gam SO3 vào dung dịch H2SO4 nồng độ 10% để được 100 gam H2SO4 phải thêm nước vào dung dịch H2SO4 50% để thu được dung dịch H2SO4 20%. Tính tỉ lệ về khối lượng nước và dung dịch axit phải dùng để thu được dung dịch 20%.
Cho 8 gam lưu huỳnh trioxit (
S
O
3
) tác dụng với
H
2
O
, thu được 250 ml dung dịch axit sunfuric (
H
2
S
O
4
). Nồng độ mol của dung dịch axit thu được là A. 0,1M B. 0,4M C. 0,5M D. 0,6M
Đọc tiếp
Cho 8 gam lưu huỳnh trioxit ( S O 3 ) tác dụng với H 2 O , thu được 250 ml dung dịch axit sunfuric ( H 2 S O 4 ). Nồng độ mol của dung dịch axit thu được là
A. 0,1M
B. 0,4M
C. 0,5M
D. 0,6M