Đốt cháy hoàn toàn 3,1 g photpho (p) trong không khí dư.Tính khối lượng của chất rắn sau phản ứng?

Những câu hỏi liên quan
Đốt cháy hoàn toàn 3,1g photpho (P) trong không khí dư. Tính khối lượng của chất rắn sau phản ứng.
7,1g.
14,2g.
5,5g.
11g.
\(n_P=\dfrac{3,1}{31}=0,1\left(mol\right)\)
PTHH: 4P + 5O2 --to--> 2P2O5
0,1-------------->0,05
=> mP2O5 = 0,05.142 = 7,1 (g)
=> A
Đúng 2
Bình luận (2)
Đốt cháy hoàn toàn 3,1 gam photpho trong không khí ( có oxi ), ta thu được 7,1 gam hợp chất đi photpho pentaoxit(P2O5). Tính khối lượng oxi tham gia phản ứng
\(4P+5O_2\underrightarrow{t^o}2P_2O_5\)
Theo ĐLBTKL, ta có:
\(m_P+m_{O_2}=m_{P_2O_5}\\ \Rightarrow m_{O_2}=7,1-3,1=4g\)
Đúng 2
Bình luận (0)
Ta có : \(m_P+m_o=m_{p_2O_5}\)
hay \(3,1+5O_2=7,1\)
\(\Rightarrow m_{O_2}=7,1=3,1=4\left(gam\right)\)
Đúng 1
Bình luận (0)
Đốt cháy hoàn toàn 3,1g photpho trong bình đựng khí Oxi dư. Sau phản ứng thu được m(g) chất rắn.
a) Tính khối lượng chất rắn thu được sau phản ứng?
b) Tính thể tích khí Oxi (ở đktc) đã dùng trong phản ứng này?
nP = 3.1/31 = 0.1 (mol)
4P + 5O2 -to-> 2P2O5
0.1__0.125_____0.05
mP2O5 = 0.05*142 = 7.1 (g)
VO2 = 0.125 * 22.4 = 2.8 (l)
Đúng 2
Bình luận (0)
Đốt cháy hoàn toàn 3,1gam photpho(P) trong không khí a,Viết chương trình phản ứng bằng chữ b, Tính khối lượng của hợp chất tạo thành sau phản ứng
a)
Photpho + Oxi → Điphotpho pentaoxit
b)
\(4P + 5O_2 \xrightarrow{t^o} 2P_2O_5\)
Ta có : \(n_P = \dfrac{3,1}{31} = 0,1(mol)\)
Theo PTHH :
\(n_{P_2O_5} = 0,5n_P = 0,05(mol)\\ \Rightarrow m_{P_2O_5} = 0,05.142 = 7,1(gam)\)
Đúng 2
Bình luận (0)
Đốt cháy hoàn toàn 3,1 gam photpho (P) trong không khí ta thu đuoc 7,1 gam hợp chất Điphotphopentaoxit.(P2O5)
a, Viết phương trình chữ của phản ứng.
b, Tính khối lượng đã tham gia phản ứng.
a) Phương trình chữ của phản ứng là :
Photpho + không khí -----> điphotphopentaoxit
( 4P + 5O2 ------> 2P2O5 )
b) Theo định luật bảo toàn khối lượng ta có :
mP + mO2 = mP2O5
=> mO = mP2O5 - mP
=> mO = 7,1g - 3,1g = 4g
Vậy lượng Oxi đã tham gia phản ứng là 4g
Đúng 2
Bình luận (0)
Bài 1 : Đốt cháy hoàn toàn 3,1 gam photpho trong không khí (có khí oxi), ta thu được 7,1 gam hợp chất Điphotpho pentaoxit(P2O5).a) Viết phương trình chữ của phản ứng.b) Viết công thức về khối lượng và tính khối lượng oxi đã tham gia phản ứng ?Bài 2 : Cho 120 gam sắt tác dụng với axit clohidric, thu được 127 gam sắt (II) clorua và 6 gam khí hidro.a) Viết công thức về khối lượng của phản ứng xảy ra ?b) Tính khối lượng axit đã dùng ?Bài 3 : Nung 150 gam CaCO3 ( canxi cacbonat) ở nhiệt độ thích hợp...
Đọc tiếp
Bài 1 : Đốt cháy hoàn toàn 3,1 gam photpho trong không khí (có khí oxi), ta thu được 7,1 gam hợp chất Điphotpho pentaoxit(P2O5).
a) Viết phương trình chữ của phản ứng.
b) Viết công thức về khối lượng và tính khối lượng oxi đã tham gia phản ứng ?
Bài 2 : Cho 120 gam sắt tác dụng với axit clohidric, thu được 127 gam sắt (II) clorua và 6 gam khí hidro.
a) Viết công thức về khối lượng của phản ứng xảy ra ?
b) Tính khối lượng axit đã dùng ?
Bài 3 : Nung 150 gam CaCO3 ( canxi cacbonat) ở nhiệt độ thích hợp thu được 66 gam CO2 ( cacbon đioxit ) và m gam CaO ( canxi oxit) .
Viết công thức về khối lượng của phản ứng xảy ra ? Tính m?
Bài 4 : Khi phân hủy hoàn toàn 24,5 gam muối kaliclorat thu được 9,6 gam khí oxi và một lượng muối kaliclorua. Tính khối lượng muối kaliclorua thu được ?
Bài 5 : Đốt cháy m gam magie trong không khí thu được 80 gam magie oxit ( MgO). Biết khối lượng magie tham gia phản ứng bằng 1,5 lần khối lượng oxi ( không khí) tham gia phản ứng. Tính khối lượng magie và oxi đã phản ứng ?
Bài 6 : Đốt cháy 1,6 gam hợp chất X cần 6,4 gam khí oxi. Sau phản úng thu được hai sản phẩm là khí cacbonic và hơi nước theo tỉ lệ khối lượng cacbonic : khối lượng nước = 11 : 9. Tính khối lượng mỗi sản phẩm thu được ?
Bài 7 : Nung nóng Fe(OH)3 ( Sắt (III) hidroxit) thu được sản phẩm là Fe2O3 ( Sắt (III) oxit) và hơi nước. Trong một thí nghiệm người ta nung nóng hoàn toàn 21,4 gam Fe(OH)3 thì thấy sau khi phản ứng kết thúc khối lượng chất rắn giảm 5,4 gam. Tính khối lượng mỗi sản phẩm thu được?
Trong một thí nghiệm khác nếu nung hoàn toàn 10,7 gam Fe(OH)3 thì khối lượng sản phẩm thu được là bao nhiêu ?
Bài 8 : Biết rằng khí nung hết a gam CaCO3 thì sau phản ứng khối lượng giảm 4,4 gam. Mặt khác nếu phân hủy hết 2a gam CaCO3 thì sau phản ứng khối lượng chất rắn là 11,2 gam. Tinh a ?
Bài 9 : Một lưỡi dao bằng sắt để ngoài trời sau một thời gian sẽ bị gỉ. Hãy cho biết khối lượng của lưỡi dao bị gỉ có thay đổi so với ban đầu không ?
Bài 10 : Đốt chất A trong khí oxi thu được sản phẩm là khí cacbon dioxit và hơi nước. Hãy cho biết :
- Nguyên tố hóa học nào bắt buộc phải có trong thành phần của chất A ?
- Nguyên tố hóa học nào có thể có hoặc không có trong thành phần của chất A ? Giải thích
1)
a) photpho+oxi--->điphotpho pentaoxit
b)M photpho+M oxi---> M điphotpho pentaoxit
3.1 + M oxi--> 7.1
M oxi = 7.1 - 3.1 = 4g
mới làm xong bài 1 bấm xem thêm thấy bất ngờ lun nên thôi ko lm nx hihi
Đúng 2
Bình luận (1)
Đốt cháy hoàn toàn 3,1 g Photpho trong bình chứa khí O2 . Sản phẩm thu được là điphotpho pentaoxit.
a. Hãy viết phương trình phản ứng xảy ra.
b. Tính thể tích khí O2 (ở đktc) đã tham gia phản ứng trên.
c. Tính khối lượng của chất được tạo thành.
Giải rồi cho mình công thức của mấy bài như vậy với ạ. Mình cảm ơn
nP = 3,1/31 = 0,1 (mol)
PTHH: 4P + 5O2 -t°-> 2P2O5
0,1---> 0,125--->0,05
VO2 = 0,125 . 22,4 = 2,8 (l)
mP2O5 = 0,05 . 142 = 7,1 (g)
Đúng 3
Bình luận (1)
\(n_P=\dfrac{3,1}{31}=0,1mol\)
\(4P+5O_2\underrightarrow{t^o}2P_2O_5\)
0,1 0,125 0,05
\(V_{O_2}=0,125\cdot22,4=2,8l\)
\(m_{P_2O_5}=0,05\cdot142=7,1g\)
Đúng 3
Bình luận (1)
a,PTHH : \(4P+5O_2->2P_2O_5\)
b,
Số mol O2 tham gia phản ứng :
nO2 = 5/4.nP = 5/4 . 0,1 = 0,125 ( mol )
=> V O2 phản ứng : 0,125 . 22,4 = 2,8 ( lít )
c,
Số mol P2O5 : np2o5 = 1/2.np = 0,05 ( mol )
=> m = 142 . 0,05 = 7,1 (g)
Đúng 2
Bình luận (1)
Đốt cháy 3,1 gam Photpho trong bình chứa 3,2 g khí Oxi. Tính khối lượng chất tạo thành sau phản ứng ?
\(n_P=\dfrac{3,1}{31}=0,1\left(mol\right)\\
n_{O_2}=\dfrac{3,2}{32}=0,1\left(mol\right)\\
pthh:4P+5O_2\underrightarrow{t^o}2P_2O_5\\
LTL:\dfrac{0,1}{4}>\dfrac{0,1}{5}\)
P dư
\(n_{P\left(p\text{ư}\right)}=\dfrac{4}{5}n_{O_2}=0,08\left(mol\right)\\
m_{P\left(d\right)}=0,08.31=0,62\left(g\right)\\
n_{P_2O_5}=\dfrac{2}{5}n_{O_2}=0,04\left(mol\right)\\
m_{P_2O_5}=0,04.142=5,68\left(g\right)\\
m_{sp}=0,62+5,68=6,3\left(g\right)\)
Đúng 2
Bình luận (0)
Nung không hoàn toàn 24,5 gam KClO3 một thời gian thu được 17,3 gam chất rắn A và khí B. Dẫn toàn bộ khí B vào bình 1 đựng 4,96 gam photpho đun nóng, phản ứng xong dẫn khí còn lại vào bình 2 đựng 0,3 gam cacbon để đốt cháy hoàn toàn. a) Tính hiệu suất của phản ứng phân hủy. b) Tính khối lượng của các chất trong mỗi bình sau phản ứng
Đọc tiếp
Nung không hoàn toàn 24,5 gam KClO3 một thời gian thu được 17,3 gam chất rắn A và khí B. Dẫn toàn bộ khí B vào bình 1 đựng 4,96 gam photpho đun nóng, phản ứng xong dẫn khí còn lại vào bình 2 đựng 0,3 gam cacbon để đốt cháy hoàn toàn.
a) Tính hiệu suất của phản ứng phân hủy.
b) Tính khối lượng của các chất trong mỗi bình sau phản ứng
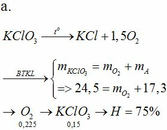
b.
4P + 5O2 → 2P2O5
0,16→ 0,2
Dư: 0,025
Sau pứ m(bình 1) = mP2O5 = 11,36 (g)
O2 + 2C → 2CO
0,025→ 0,05 0,05
Dư: 0,25
Sau pứ m(bình 2) = mCdư = 3 (g)
Đúng 0
Bình luận (0)
Phân hủy hoàn toàn 47,4g KMnO4 thu được m (g) chất rắn và V (lít)khí ở (đktc):
a) tính m=?. V=?.
b) Dùng toàn bộ lượng khí O2 thu được ở trên đeể đốt cháy 3,1 (g) P. Sau phản ứng hoàn toàn tính khối lượng P2O5 tạo ra?
2KMnO4-to>K2MnO4+MnO2+O2
0,3-----------------0,15-----0,15------0,15 mol
n KMnO4=\(\dfrac{47,4}{158}\)=0,3 mol
=>mcr=0,15.197.0,15.87=42,6g
=>VO2=0,15.22,4=3,36l
b) 4P+5O2-to>2P2O5
0,1--------------0,05
nP=\(\dfrac{3,1}{31}\)=0,1 mol
->O2 dư
=>m P2O5=0,05.142=7,1g
Đúng 1
Bình luận (0)
mKMnO4 = 47,4/158 = 0,3 (mol)
PTHH: 2KMnO4 -> (t°) K2MnO4 + MnO2 + O2
Mol: 0,3 ---> 0,15 ---> 0,15 ---> 0,15
m = 0,15 . 197 + 0,15 . 87 = 85,2 (g)
V = VO2 = 0,15 . 22,4 = 3,36 (l)
nP = 3,1/31 = 0,1 (mol)
PTHH: 4P + 5O2 -> (t°) 2P2O5
LTL: 0,1/4 < 0,15/5 => O2 dư
nP2O5 = 0,1/2 = 0,05 (mol)
mP2O5 = 0,05 . 142 = 7,1 (g)
mKMnO4 = 47,4/158 = 0,3 (mol)
PTHH: 2KMnO4 -> (t°) K2MnO4 + MnO2 + O2
Mol: 0,3 ---> 0,15 ---> 0,15 ---> 0,15
m = 0,15 . 197 + 0,15 . 87 = 42,6 (g)
V = VO2 = 0,15 . 22,4 = 3,36 (l)
nP = 3,1/31 = 0,1 (mol)
PTHH: 4P + 5O2 -> (t°) 2P2O5
LTL: 0,1/4 < 0,15/5 => O2 dư
nP2O5 = 0,1/2 = 0,05 (mol)
mP2O5 = 0,05 . 142 = 7,1 (g)
Đúng 0
Bình luận (0)





























