Một hh khí A gồm 2 oxit khác của lưu huỳnh. Cho phân tích hh khí A người ta thấy trong A chứa 24 g lưu huỳnh và 32g oxi. Xác định tỉ lệ thể tích 2 oxit chứa trong kim loại

Những câu hỏi liên quan
Phân tích một oxit của lưu huỳnh người ta thấy cứ 2 phần khối lượng S thì có 3 phần khối lượng oxi. Xác định công thức của oxit lưu huỳnh?
Coi: mS = 2a (g) ⇒ mO = 3a (g)
\(\Rightarrow n_S=\dfrac{2a}{32}=\dfrac{a}{16}\left(mol\right)\)
\(n_O=\dfrac{3a}{16}\left(mol\right)\)
Gọi CTHH cần tìm là SxOy.
\(\Rightarrow x:y=\dfrac{a}{16}:\dfrac{3a}{16}=1:3\)
Vậy: CTHH cần tìm là SO3.
Đúng 2
Bình luận (0)
Gọi x, y lần lượt là số ml của S và O
Do tỉ lệ số mol của các chất chình là tỉ lệ giữa sô phân tử của nguyên tố cấu tạo nên chất
⇒ Công thức tổng quát SxOy
Theo đề bài, ta có: mS/mO = 2/3
=> 32x/16y = 2/3
=> 96/x = 32/y
=> x/y = 32/96 = 1/3
=> x = 1;
y = 3
=> Công thức hóa học: SO3
Đúng 0
Bình luận (0)
A là khí không màu mùi hắc, rất độc và nặng hơn không khíHãy xác định công thức của hợp chất khí A, biết rằng+ A là oxit của lưu huỳnh chứa 50% oxi + 1 gam khí A chiếm thể tích 0,35 lít ở đktc A. SO B.
SO
3
C.
SO
2
D.
NO
2
Đọc tiếp
A là khí không màu mùi hắc, rất độc và nặng hơn không khí
Hãy xác định công thức của hợp chất khí A, biết rằng
+ A là oxit của lưu huỳnh chứa 50% oxi
+ 1 gam khí A chiếm thể tích 0,35 lít ở đktc
A. SO
B. SO 3
C. SO 2
D. NO 2
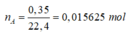
M A = m A n A = 1 0,015625 = 64 g / m o l
- Tìm số mol nguyên tử S, O trong phân tử A
Cứ 1 mol phân tử A có:
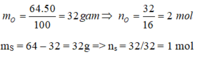
Suy ra trong 1 phân tử A có 1S và 2O, công thức của A là SO 2
Đáp án: C
Đúng 0
Bình luận (0)
Đun hh gồm 2,97g Al và 4,08 Lưu huỳnh trong bình kín ko có không khí cho sản phẩm tác dụng với axit HCl đủ trong hh khí A. Tính % thể tích các khí trong hh A
nAl = 2.97/27 = 0.11 (mol)
nS = 0.1275 (mol)
2Al + 3S -to-> Al2S3
0.085_0.1275__0.0425
nAl dư = 0.025 mol
2Al + 6HCl => 2AlCl3 + 3H2
0.025_______________0.0375
Al2S3 + 6HCl => 2AlCl3 + 3H2S
0.0425_________________0.1275
%VH2 = 0.0375/(0.0375 + 0.1275) * 100% - 22.43%
%VH2S = 77.27%
Đúng 2
Bình luận (0)
c8: đốt cháy 4,8g kim loại magie trong bình chứa oxi(o2) thì thu dc 8g magie oxit mgo a, lập PTHH của phản ứng trên b, vt công thức về klg của phản ứng và tính klg khí oxi (o2) đã phản ứng c9 : cho bt hc gồm 2 ngto lưu huỳnh (VI) và oxi a, lập CTHH của hc b, tính tp % klg của mỗi nguyên tố hh
C8:
a) 2Mg + O2 --to--> 2MgO
b) Theo ĐLBTKL: \(m_{Mg}+m_{O_2}=m_{MgO}\) (1)
=> \(n_{O_2}=8-4,8=3,2\left(g\right)\)
c9
a) Áp dụng quy tắc hóa trị => CTHH: SO3
b) \(\left\{{}\begin{matrix}\%S=\dfrac{1.32}{80}.100\%=40\text{%}\\\%O=\dfrac{3.16}{80}.100\%=60\%\end{matrix}\right.\)
Đúng 1
Bình luận (0)
Đốt cháy hoàn toàn 3.2 gam lưu huỳnh trong khí oxi, thu được lưu huỳnh đioxit
A. Viết phương trình HH của phản ứng xảy ra?
B. Tính thể tích khí oxi ở đktc cần dùng?
Xem chi tiết
a) PTHH : \(S+O_2->SO_2\)
b) Ta có : \(n_S\) = \(\dfrac{m_S}{M_S}\) = 0.1 (mol)
Có : \(n_S=n_{O_2}\)
--> \(n_{O_2}\) = 0.1 (mol)
=> \(V_{O_2\left(đktc\right)}\) = \(n_{O_2}\) . 22.4 = 2.24 (L)
Đúng 2
Bình luận (0)
\(n_S=\dfrac{3,2}{32}=0,1\left(mol\right)\\ PTHH:S+O_2\underrightarrow{t^o}SO_2\\ \left(mol\right)..0,1\rightarrow0,1..0,1\\ V_{O_2}=0,1.22,4=2,24\left(l\right)\)
Đúng 0
Bình luận (0)
Trong một bình trộn khí S O 2 với S O 3 . Khi phân tích người ta thấy có 2,4 gam lưu huỳnh và 2,8 gam oxi. Xác định tỉ số mol S O 2 với S O 3 trong bình.
Bài tập 2:Đốt cháy sắt trong khí oxi, sau phản ứng thu được 11,6g oxit sắt từ Fe3O4a. Viết PTHHb. Tính thể tích khí oxi cần dùng (đktc)Bài tập 3:Đốt cháy lưu huỳnh (S) trong oxi không khí thu được 6,4g lưu huỳnh đioxit (SO2 ).a. Viết PTHH của phản ứng xảy ra?b. Tính khối lượng của lưu huỳnh đã tham gia?c. Tính thể tích khí oxi cần trong phản ứng trên?d. Thể tích không khí đã dùng ở phản ứng trên? (Thể tích các khí đo ở đktc)Bài tập 4: Phân loại và gọi tên các oxit sau: CO2, HgO,...
Đọc tiếp
Bài tập 2:
Đốt cháy sắt trong khí oxi, sau phản ứng thu được 11,6g oxit sắt từ Fe3O4
a. Viết PTHH
b. Tính thể tích khí oxi cần dùng (đktc)
Bài tập 3:
Đốt cháy lưu huỳnh (S) trong oxi không khí thu được 6,4g lưu huỳnh đioxit (SO2 ).
a. Viết PTHH của phản ứng xảy ra?
b. Tính khối lượng của lưu huỳnh đã tham gia?
c. Tính thể tích khí oxi cần trong phản ứng trên?
d. Thể tích không khí đã dùng ở phản ứng trên? (Thể tích các khí đo ở đktc)
Bài tập 4: Phân loại và gọi tên các oxit sau:
CO2, HgO, MgO, FeO, N2O, Li2O, SO3, CaO, CO, BaO; P2O5 ;Na2O; NO2 , Al2O3, ZnO
bài tập 2
3Fe + 2O2 -\(-^{t^o}->\) Fe3O4 (1)
ADCT n= m/M
\(n_{fe_3O_4}\)= 11,6/ 232= 0,05 mol
Theo pt(1) có
\(\dfrac{n_{O2}}{n_{Fe3O4}}\)=\(\dfrac{2}{1}\)
-> \(n_{O2}\)= 2/1 x \(n_{fe3o4}\)
= 0,1 mol
ADCT V= n x 22,4
Vo2= 0,1 x 22,4
= 2,24 (l)
Đúng 1
Bình luận (0)
bài tập 4
OXIT AXIT:
- CO2: Cacbon đi oxit
- N2O: đi ni tơ oxit
- SO3: Lưu huỳnh tri oxit
- CO: cacbon oxit
P2O5: đi photpho penta oxit
NO2: Nitơ đi oxit
OXIT BA ZƠ
- HgO: thủy ngân (II) oxit
- MgO: Magie oxit
- FeO: sắt (II) oxit
- Li2O: liti oxit
-CaO: canxi oxit
- BaO: bari oxit
- Na2O: natri oxit
- Al2O3 : Nhôm oxit
ZnO: kẽm oxit
Đúng 0
Bình luận (0)
Bổ sung bài 3:
\(a,n_{SO_2}=\dfrac{6,4}{64}=0,1\left(mol\right)\\ PTHH:S+O_2\underrightarrow{t^o}SO_2\\ \left(mol\right)..0,1...0,1\leftarrow0,1\\ b,m_S=0,1.32=3,2\left(g\right)\\ c,V_{O_2}=0,1.22,4=2,24\left(l\right)\\ d,V_{kk}=5.V_{O_2}=5.2,24=11,2\left(l\right)\)
Đúng 0
Bình luận (0)
Xem thêm câu trả lời
Câu 13: Đốt 9,6 g lưu huỳnh trong không khí sinh ra lưu huỳnh đi oxit. Tính
a. Thể tích không khí cần dùng.
b. Khối lượng và thể tích (đktc) sản phẩm.
giúp mik với nha :))
S + O2 ---> SO2
0,3 0,3 0,3
nS = 9,6 / 32 = 0,3 (mol)
=> Vkk = 0,3 . 22,4 . 5 = 33,6 (l)
mSO2 = 0,3 . 64 = 19,2 (g)
V SO2 = 0,3 . 22,4 = 6,72 (l)
Đúng 2
Bình luận (0)
Câu 13 :
a. \(n_S=\dfrac{9.6}{32}=0,3\left(mol\right)\)
PTHH : S + O2 ---to---> SO2
0,3 0,3 0,3
\(V_{O_2}=0,3.22,4=6,72\left(l\right)\)
\(\Rightarrow V_{kk}=6,72.5=33,6\left(l\right)\)
b. \(m_{SO_2}=0,3.64=19,2\left(g\right)\)
\(V_{SO_2}=0,3.22,4=6,72\left(l\right)\)
Đúng 1
Bình luận (0)
Đốt cháy hoàn toàn 7,68 g hỗn hợp rắn A gồm Cacbon và lưu huỳnh trong khí oxi thu được 9,856 lít hỗn hợp khí gồm lưu huỳnh đioxit và Cacbon oxit .tính phần trăm khối lượng của mỗi chất rắn trong hỗn hợp A
Gọi số mol C, S là a, b
=> 12a + 32b = 7,68
PTHH: C + O2 --to--> CO2
_____a--------------->a
S + O2 --to--> SO2
b--------------->b
=> a + b = \(\dfrac{9,856}{22,4}=0,44\)
=> a = 0,32; b = 0,12
=> \(\left\{{}\begin{matrix}\%C=\dfrac{0,32.12}{7,68}.100\%=50\%\\\%S=\dfrac{0,12.32}{7,68}.100\%=50\%\end{matrix}\right.\)
Đúng 4
Bình luận (0)



























