hỗn hợp khí x gồm 0.1mol N2 và 0.05mol khí NO. tính tỉ khối của khí X so vs H2

Những câu hỏi liên quan
Cho 11,2 (l) hỗn hợp khí gồm N2 và NO, có tỉ khối của hỗn hợp khí so vs Hidro là 14,5. Tính khối lượng của hh khí.
$n_{khí} = \dfrac{11,2}{22,4} = 0,5(mol)$
$M_{khí} = 2M_{H_2} = 14,5.2 = 29(g/mol)$
$\Rightarrow m_{khí} = M.n = 29.0,5 = 14,5(gam)$
Đúng 2
Bình luận (0)
Tính tỉ khối hơi của hỗn hợp Y có đồng khối lượng gồm khí C2H2 , N2 và khí C0 so vs khí H2 ??
Một hỗn hợp đồng khối lượng khí C2H2, N2 và khí CO => Khối lượng N2 = Khối lượng CO = Khối lượng C2H2
=> Tỉ khối của hỗn hợp Y so với khí H2 là
\(\dfrac{12.2+1.2+14.2+12+16}{1.2}\)= 41
Đúng 1
Bình luận (0)
Nung hỗn hợp khí X gồm CO và O2 tỉ khối của X so với H2 là 14,5 được hỗn hợp khí B có tỉ khối so với hỗn hợp khí C (C2H4 và N2) là 58/49. Tính hiệu xuất của phản ứng
Tính phần trăm thể tích mỗi khí trong hỗn hợp X biết:
(a) Hỗn hợp X gồm khí O2 và O3 có tỉ khối so với hiđro là 20.
(b) Hỗn hợp X gồm khí N2 và NO có tỉ khối so với hiđro là 14,75.
a) Gọi nO2 =a (mol); nO3 = b(mol)
Có: \(\dfrac{32a+48b}{a+b}=20.2=40\)
=> 32a + 48b = 40a + 40b
=> 8a = 8b => a = b
=> \(\left\{{}\begin{matrix}\%V_{O_2}=\dfrac{a}{a+b}.100\%=\dfrac{a}{a+a}.100\%=50\%\\\%V_{O_3}=100\%-50\%=50\%\end{matrix}\right.\)
b) Gọi nN2 =a (mol); nNO = b(mol)
Có: \(\dfrac{28a+30b}{a+b}=14,75.2=29,5\)
=> 28a + 30b = 29,5a + 29,5b
=> 1,5a = 0,5b
=> 3a = b
=> \(\left\{{}\begin{matrix}\%V_{N_2}=\dfrac{a}{a+b}.100\%=\dfrac{a}{a+3a}.100\%=25\%\\\%V_{NO}=100\%-25\%=75\%\end{matrix}\right.\)
Đúng 1
Bình luận (0)
Cho 12,395 lít hỗn hợp khí X gồm N2 và NO,tỉ khối của x so với khí hydrogen là 14,5 a) Tính số mol mỗi khí trong hỗn hợp khí x b) Tính % khối lượng mỗi khí trong x
Đọc tiếp
Cho 12,395 lít hỗn hợp khí X gồm N2 và NO,tỉ khối của x so với khí hydrogen là 14,5 a) Tính số mol mỗi khí trong hỗn hợp khí x b) Tính % khối lượng mỗi khí trong x
Gọi \(\left\{{}\begin{matrix}n_{N_2}=x\left(mol\right)\\n_{NO}=y\left(mol\right)\end{matrix}\right.\)
\(n_{hh}=\dfrac{12,395}{24,79}=0,5\left(mol\right)\) (chắc đkc nhỉ vì đktc số kì: )
=> x + y = 0,5 (1)
Tỉ khối của X so với khí `H_2` là 14,5 có:
\(M_X=14,5.2=29\left(g/mol\right)\\ \Leftrightarrow\dfrac{28x+30y}{x+y}=29\\ \Rightarrow x-y=0\left(2\right)\)
Từ (1), (2) có: \(\left\{{}\begin{matrix}x+y=0,5\\x-y=0\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}x=0,25\\y=0,25\end{matrix}\right.\) (bấm máy giải hệ)
a
Số mol mỗi khí trong hỗn hợp khí X: \(n_{N_2}=n_{NO}=0,25\left(mol\right)\)
b
\(\%_{m_{N_2}}=\dfrac{0,25.28.100\%}{0,25.28+0,25.30}=48,28\%\)
\(\%_{m_{NO}}=100\%-48,28\%=51,72\%\)
Đúng 2
Bình luận (0)
Bài 9*** : Hỗn hợp khí X gồm 3 khí (CO2, N2O, C3H8). Hỗn hợp khí Y gồm 3 khí (CO, N2, C2H4). Câu a. Tính tỉ khối của hỗn hợp khí X so với không khí? Câu b. Tính tỉ khối của hỗn hợp khí Y so với không khí? Câu c. Tính tỉ khối của hỗn hợp khí X so với hỗ hợp khí Y. (dX/Y) 09:38/-heart7
Đọc tiếp
Bài 9*** : Hỗn hợp khí X gồm 3 khí (CO2, N2O, C3H8). Hỗn hợp khí Y gồm 3 khí (CO, N2, C2H4). Câu a. Tính tỉ khối của hỗn hợp khí X so với không khí? Câu b. Tính tỉ khối của hỗn hợp khí Y so với không khí? Câu c. Tính tỉ khối của hỗn hợp khí X so với hỗ hợp khí Y. (dX/Y) 09:387
Một hỗn hợp khí X gồm 2 khí N2 và H2 có tỉ khối so với H2 bằng 4,9. Đun nóng hỗn hợp X một thời gian trong bình kín (có bột Fe làm xúc tác), thu được hỗn hợp khí Y có tỉ khối so với H2 bằng 6,125. Hiệu suất của phản ứng tổng hợp NH3 là? A. 33,33% B. 42,85% C. 66,67% D. 30%
Đọc tiếp
Một hỗn hợp khí X gồm 2 khí N2 và H2 có tỉ khối so với H2 bằng 4,9. Đun nóng hỗn hợp X một thời gian trong bình kín (có bột Fe làm xúc tác), thu được hỗn hợp khí Y có tỉ khối so với H2 bằng 6,125. Hiệu suất của phản ứng tổng hợp NH3 là?
A. 33,33%
B. 42,85%
C. 66,67%
D. 30%
Đáp án B
Áp dụng phương pháp đường chéo cho hỗn hợp X:
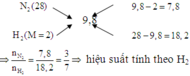
Cách 1: Gọi số mol N2 là 3x thì số mol H2 là 7x ⇒ tổng số mol hỗn hợp X là 3x + 7x = 10x
Thay vào công thức:
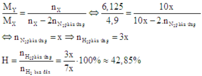
Cách 2: Áp dụng công thức tính nhanh với trường hợp x < 3y:
Hiệu suất phản ứng:
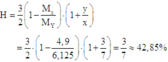
Đúng 0
Bình luận (0)
Bài 1. a) Tính tỉ khối hơi của khí SO2 so với khí O2 N2, SO3, CO, N2O, NO2.b) Tính tỉ khối hơi của hỗn hợp khí A gồm SO2 và O2 có tỉ lệ mol 1:1 đối với khí O2.Bài 2. a) Tính tỉ khối hơi của hỗn hợp khí X gồm hai khí N2 và CO đối với khí metan CH4. Hỗn hợp X nặng hay nhẹ hơn không khí?b) Tính tỉ khối hơi của hỗn hợp Y đồng khối lượng gồm khí C2H4 (etilen), N2 và khí CO so với khí H2.c) Hỗn hợp khí X gồm: NO, NxO, CH4. Trong đó NO chiếm 30% về thể tích, NxO chiếm 30% còn lại là CH4. Trong hỗn hợp...
Đọc tiếp
Bài 1. a) Tính tỉ khối hơi của khí SO2 so với khí O2 N2, SO3, CO, N2O, NO2.
b) Tính tỉ khối hơi của hỗn hợp khí A gồm SO2 và O2 có tỉ lệ mol 1:1 đối với khí O2.
Bài 2. a) Tính tỉ khối hơi của hỗn hợp khí X gồm hai khí N2 và CO đối với khí metan CH4. Hỗn hợp X nặng hay nhẹ hơn không khí?
b) Tính tỉ khối hơi của hỗn hợp Y đồng khối lượng gồm khí C2H4 (etilen), N2 và khí CO so với khí H2.
c) Hỗn hợp khí X gồm: NO, NxO, CH4. Trong đó NO chiếm 30% về thể tích, NxO chiếm 30% còn lại là CH4. Trong hỗn hợp CH4 chiếm 22,377% về khối lượng. Xác định công thức hoá học của NxO. Tính tỷ khối của X so với không khí
Bài 2:
a) Vì khối lượng mol của N2 và CO đều bằng 28 và lớn hơn khối lượng mol của khí metan CH4 (28>16)
=> \(d_{\dfrac{hhX}{CH_4}}=\dfrac{28}{16}=1,75\)
Hỗn hợp X nhẹ hơn không khí (28<29)
b)
\(M_{C_2H_4}=M_{N_2}=M_{CO}=28\left(\dfrac{g}{mol}\right)\\ \rightarrow M_{hhY}=28\left(\dfrac{g}{mol}\right)\\ d_{\dfrac{Y}{H_2}}=\dfrac{28}{2}=14\)
c) \(\%V_{NO}=100\%-\left(30\%+30\%\right)=40\%\\ \rightarrow\%n_{CH_4}=40\%\\ Vì:\%m_{CH_4}=22,377\%\\ Nên:\dfrac{30\%.16}{40\%.30+30\%.16+30\%.\left(x.14+16\right)}=22,377\%\\ \Leftrightarrow x=-0,03\)
Sao lại âm ta, để xíu anh xem lại như nào nhé.
Đúng 2
Bình luận (4)
Bài 1:
\(a.\\ d_{\dfrac{SO_2}{O_2}}=\dfrac{64}{32}=2\\ d_{\dfrac{SO_2}{N_2}}=\dfrac{64}{28}=\dfrac{16}{7}\\ d_{\dfrac{SO_2}{SO_3}}=\dfrac{64}{80}=0,8\\ d_{\dfrac{SO_2}{CO}}=\dfrac{64}{28}=\dfrac{16}{7}\\ d_{\dfrac{SO_2}{N_2O}}=\dfrac{64}{44}=\dfrac{16}{11}\\ d_{\dfrac{SO_2}{NO_2}}=\dfrac{64}{46}=\dfrac{32}{23}\\ b.M_{hhA}=\dfrac{1.64+1.32}{1+1}=48\left(\dfrac{g}{mol}\right)\\ d_{\dfrac{hhA}{O_2}}=\dfrac{48}{32}=1,5\)
Đúng 4
Bình luận (2)
Hỗn hợp X gồm các khí H2, O2, SOx. Biết thành phần phần trăm về thể tích các khí trong hỗn hợp X là: . Trong hỗn hợp SOx chiếm 62,5% về khối lượng.
a) Xác định công thức hoá học của SOx.
b) Hỗn hợp khí Y gồm N2 và CO. Tính tỉ khối của hỗn hợp khí X đối với hỗn hợp khí Y.























