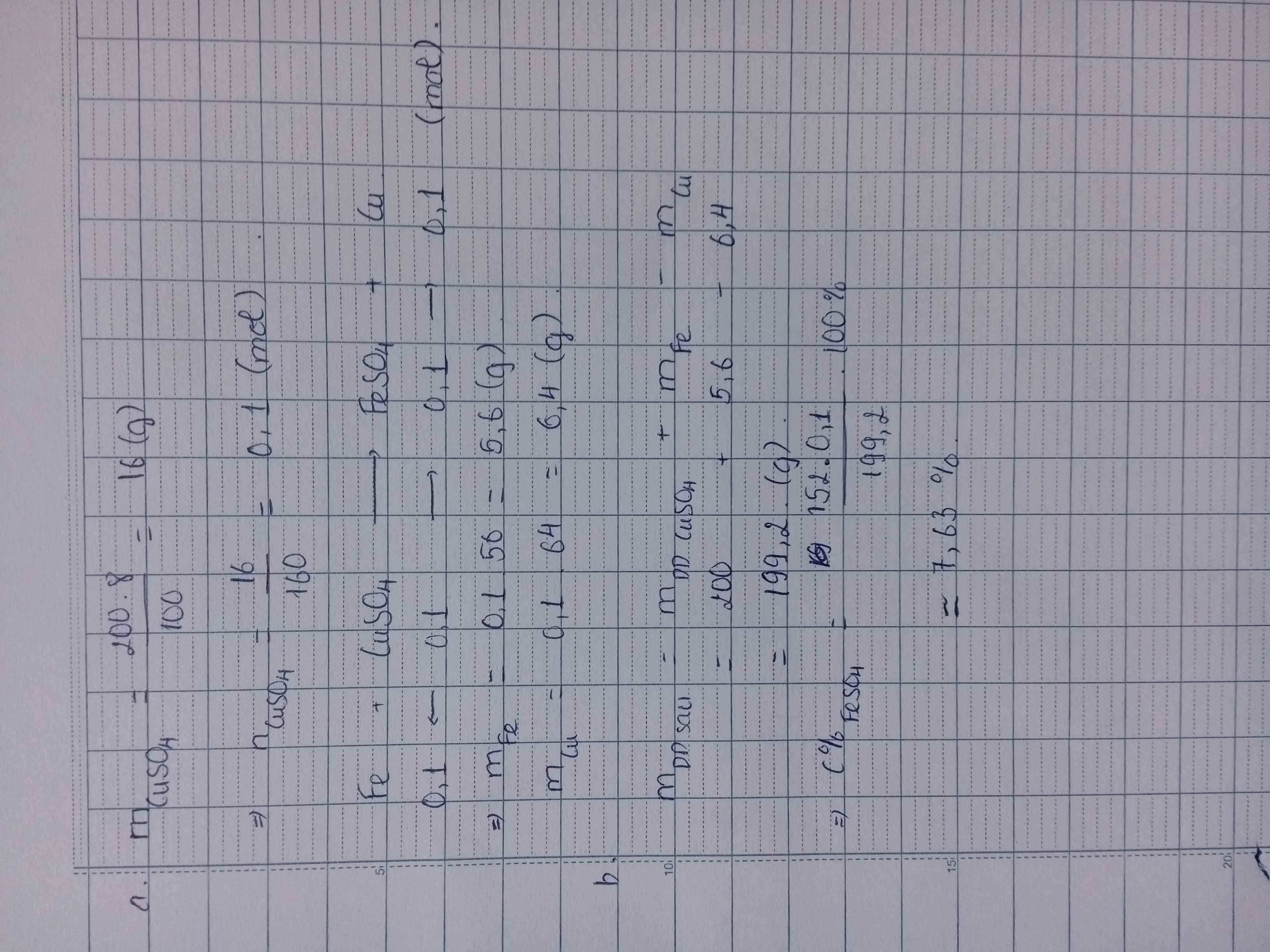Ngâm 1 lá nhôm vào 200 gam dung dịch \(H_2SO_{4_{\left(loãng\right)}}\) nồng độ a%.Đến khi lá nhôm không còn tan được nữa ,thu được dung dịch muối có nồng độ 10%

Những câu hỏi liên quan
Ngâm 1 lá nhôm vào 200g dung dịch H2SO4 loãng nồng độ a%.Đến khi lá nhôm không còn tan được nữa,người ta thu được dung dịch muối nồng độ 10%.Tính a?
Xem chi tiết
PTHH: \(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\uparrow\)
2x 3x x 3x (mol)
Ta có: \(m_{ddsaup/ứ}=m_{Al}+m_{ddH_2SO_4}-m_{H_2}=54x+200-6x\left(g\right)\)
Dung dịch muối có nồng độ 10%
\(\Rightarrow\dfrac{342x}{54x+200-6x}=0,1\) \(\Rightarrow x=\dfrac{50}{843}\left(mol\right)\)
\(\Rightarrow C\%_{H_2SO_4}=a\%=\dfrac{\dfrac{50}{243}\cdot98}{200}\cdot100\%\approx10,08\%\)
Đúng 2
Bình luận (0)
Ngâm 1 lá nhôm vào 200g dung dịch H2SO4 loãng nồng độ a%.Đến khi lá nhôm không còn tan được nữa,người ta thu được dung dịch muối nồng độ 10%.Tính a?
Ngâm lá nhôm vào 241,5 gam dung dịch ZnSO4 10 % cho đến khi nhôm không tan được nữa. Tính: a/ Khối lượng nhôm phản ứng và khối lượng kẽm sinh ra b/ Nồng độ % muối trong dung dịch sau phản ứng
\(m_{ZnSO_4}=\dfrac{241,5.10}{100}=24,15\left(g\right)=>n_{ZnSO_4}=\dfrac{24,15}{161}=0,15\left(mol\right)\)
PTHH: 2Al + 3ZnSO4 --> Al2(SO4)3 + 3Zn
_____0,1<----0,15-------->0,05----->0,15
=> mAl = 0,1.27 = 2,7(g)
=> mZn = 0,15.65=9,75(g)
b) mdd sau pư = 2,7 + 241,5 - 9,75 = 234,45(g)
=> \(C\%\left(Al_2\left(SO_4\right)_3\right)=\dfrac{0,05.342}{234,45}.100\%=7,294\%\)
Đúng 3
Bình luận (1)
Hoà tan hoàn toàn m gam CuO trong 98g dung dịch H2so4 loãng có nồng độ C1% Sau phản ứng thu được dung dịch X. Ngâm một lá sắt vào dung dịch X không thấy khí bay ra và khi dung dịch X không còn màu xanh, người ta lấy lá sắt ra rửa sạch, sấy khô, cân lại thấy khối lượng lá sắt tăng 1,6g. (Biết các phản ứng xảy ra hoàn toàn và toàn bộ Cu sinh ra đều bám trên lá sắt).a) Viết các phương trình phản ứng xảy ra.b) Tính khối lượng m của CuO ban đầu.c) Tính nồng độ C1% của dd h2so4 loãng đã dùngd) Tính n...
Đọc tiếp
Hoà tan hoàn toàn m gam CuO trong 98g dung dịch H2so4 loãng có nồng độ C1% Sau phản ứng thu được dung dịch X. Ngâm một lá sắt vào dung dịch X không thấy khí bay ra và khi dung dịch X không còn màu xanh, người ta lấy lá sắt ra rửa sạch, sấy khô, cân lại thấy khối lượng lá sắt tăng 1,6g. (Biết các phản ứng xảy ra hoàn toàn và toàn bộ Cu sinh ra đều bám trên lá sắt).
a) Viết các phương trình phản ứng xảy ra.
b) Tính khối lượng m của CuO ban đầu.
c) Tính nồng độ C1% của dd h2so4 loãng đã dùng
d) Tính nồng đồ phần trăm của muối thu được trong dd sau khi đã lấy lá sắt ra.
refer
a)CuO+H2SO4→CuSO4+H2OCuO+H2SO4→CuSO4+H2O
CuSO4+Fe→FeSO4+CuCuSO4+Fe→FeSO4+Cu
b)
Khối lượng lá sắt tăng lên chính là khối lượng sắt bị hòa tan ( trừ đi) và khối lượng Đồng bám vào( tăng lên)
nCuO=1,664−56=0,2 molnCuO=1,664−56=0,2 mol
mCuO=0,2.80=16gmCuO=0,2.80=16g
c) Theo PTHH ta có:
→nH2SO4=0,2 mol→nH2SO4=0,2 mol
mH2SO4=0,2.98=19,6gmH2SO4=0,2.98=19,6g
C%=mH2SO4mdd=19,698.100=20%C%=mH2SO4mdd=19,698.100=20%
d) theo PTHH ta có:
nFeSO4=nCu=0,2 molnFeSO4=nCu=0,2 mol
BTKL:mCuO+mddH2SO4+mFePU−mCu=16+98+0,2.56−0,2.64=112,4gBTKL:mCuO+mddH2SO4+mFePU−mCu=16+98+0,2.56−0,2.64=112,4g
C%FeSO4=0,2.152112,4.100=27,04%
Đúng 0
Bình luận (0)
Ngâm một lá Zn trong 20 gam dung dịch CuSO4 có nồng độ 10% cho đến khi kẽm không tan được nữa a) Tính khối lượng kém đã tham gia phản ứng với dung dịch trên .b)Tính nồng độ phần trăm của dung dịch sau phản ứng
PTHH : \(Zn+CuSO_4\rightarrow ZnSO_4+Cu_{\downarrow}\)
Đúng 2
Bình luận (0)
Hòa tan hoàn toàn m gam CuO trong 122,5 gam dung dịch H2 SO4 loãng có nồng độ C%. Sau phản ứng thu được dung dịch X. Ngâm 1 lá sắt vào dung dịch X không thấy khí bay ra và khi dung dịch X không còn màu xanh, người ta Lấy lá sắt ra rửa nhẹ, sấy khô, cân lại thấy khối lượng lá sắt tăng 2 gam. Biết các phản ứng xảy ra hoàn toàn và toàn bộ Cu sinh ra đều bám trên lá sắt.a) Tính m và C.b) Tính nồng độ phần trăm của dung dịch sau khi lấy lá sắt ra.
Đọc tiếp
Hòa tan hoàn toàn m gam CuO trong 122,5 gam dung dịch H2 SO4 loãng có nồng độ C%. Sau phản ứng thu được dung dịch X. Ngâm 1 lá sắt vào dung dịch X không thấy khí bay ra và khi dung dịch X không còn màu xanh, người ta Lấy lá sắt ra rửa nhẹ, sấy khô, cân lại thấy khối lượng lá sắt tăng 2 gam. Biết các phản ứng xảy ra hoàn toàn và toàn bộ Cu sinh ra đều bám trên lá sắt.
a) Tính m và C.
b) Tính nồng độ phần trăm của dung dịch sau khi lấy lá sắt ra.
a) Khi ngâm lá sắt vào dung dịch X thì không thấy khí thoát ra nên Cuo và H2SO4 phản ứng vừa đủ với nhau .
\(CuO+H_{2^{ }_{ }}SO_{4_{ }}\rightarrow CuSO_{4_{ }}+H_2O\left(1\right)\)
Khi dung dịch X không còn màu xanh thì CuSO4 đã phản ứng hết
\(CuSO_4+Fe\rightarrow FeSO_{4_{ }}+Cu\left(2\right)\)
Theo phản ứng (1) và (2)
\(n_{Cuo}=n_{H_2SO_4}=n_{CuSO_4}=n_{Cu}=\frac{2}{64-56}=0,25\left(mol\right)\)
Nồng độ phần trăm của dung dịch H2SO4
\(C\%_{H_2SO_4}=\frac{0,25.98}{122,5}.100\%=20\%\Rightarrow C=20\)
b) Khối lượng của dung dịch sau phản ứng:
\(m_{dd}=m_{CuO}+m_{ddH_2SO_4}-\left(m_{Cu}-m_{Fe}\right)=20+122,5-2=140,5\left(g\right)\)
Theo phản ứng (2) :
\(n_{FeSO_4}=n_{Cu}=0,25\left(mol\right)\Rightarrow m_{FeSO_4}=0,25.152=38\left(g\right)\)
Nồng độ phần trăm của dung dịch sau khi lấy sắt ra là:
\(C\%_{FeSO_4}=\frac{38}{140,5}.100\%=27,05\%\)
Đúng 0
Bình luận (0)
Ngâm một lá kẽm trong 40 gam dung dịch \(CuSO_4\) 10% cho đến khi kẽm không tan được nữa. Tính khối lượng kẽm đã phản ứng với dd Cu\(SO_4\) và nồng độ phần trăm của dung dịch sau phản ứng
Ta có: \(m_{CuSO_4}=40.10\%=4\left(g\right)\Rightarrow n_{CuSO_4}=\dfrac{4}{160}=0,025\left(mol\right)\)
PT: \(Zn+CuSO_4\rightarrow ZnSO_4+Cu\)
Theo PT: \(n_{Zn}=n_{ZnSO_4}=n_{Cu}=n_{CuSO_4}=0,025\left(mol\right)\)
\(\Rightarrow m_{Zn}=0,025.65=1,625\left(g\right)\)
Ta có: m dd sau pư = 1,625 + 40 - 0,025.64 = 40,025 (g)
\(\Rightarrow C\%_{ZnSO_4}=\dfrac{0,025.161}{40,025}.100\%\approx10,056\%\)
Đúng 2
Bình luận (0)
Ngâm thỏi sắt vào 200 gam dung dịch CuSO4 8% cho đến khi sắt không tan được nữa. Tính a/_Khối lượng sắt phản ứng và khối lượng đồng sinh ra b/ Nồng độ % muối trong dung dịch sau phản ứng
\(n_{CuSO_4}=\dfrac{200.8}{100.160}=0,1(mol)\\ PTHH:Fe+CuSO_4\to FeSO_4+Cu\\ a,n_{Cu}=n_{Fe}=n_{CuSO_4}=0,1(mol)\\ \Rightarrow m_{Cu}=0,1.64=6,4(g);m_{Fe}=0,1.56=5,6(g)\\ b,n_{FeSO_4}=0,1(mol)\\ \Rightarrow C\%_{FeSO_4}=\dfrac{0,1.152}{5,6+200-6,4}.100\%=7,63\%\)
Đúng 2
Bình luận (1)
Bài 2: Ngâm một lá nhôm có khối lượng 10 gam vào 500 ml dung dịch đồng (II) sunfat 0,4M cho tới khi nhôm không thể tan thêm được nữa. Lấy lá nhôm ra, rửa nhẹ, làm khô và cân thì thấy khối lượng là 11,38 g. a. Tính khối lượng đồng thoát ra bám vào miếng nhôm? b. Tính nồng độ mol của các chất thu được sau phản ứng.Biết thể tích dung dịch thay đổi ko đáng kể.