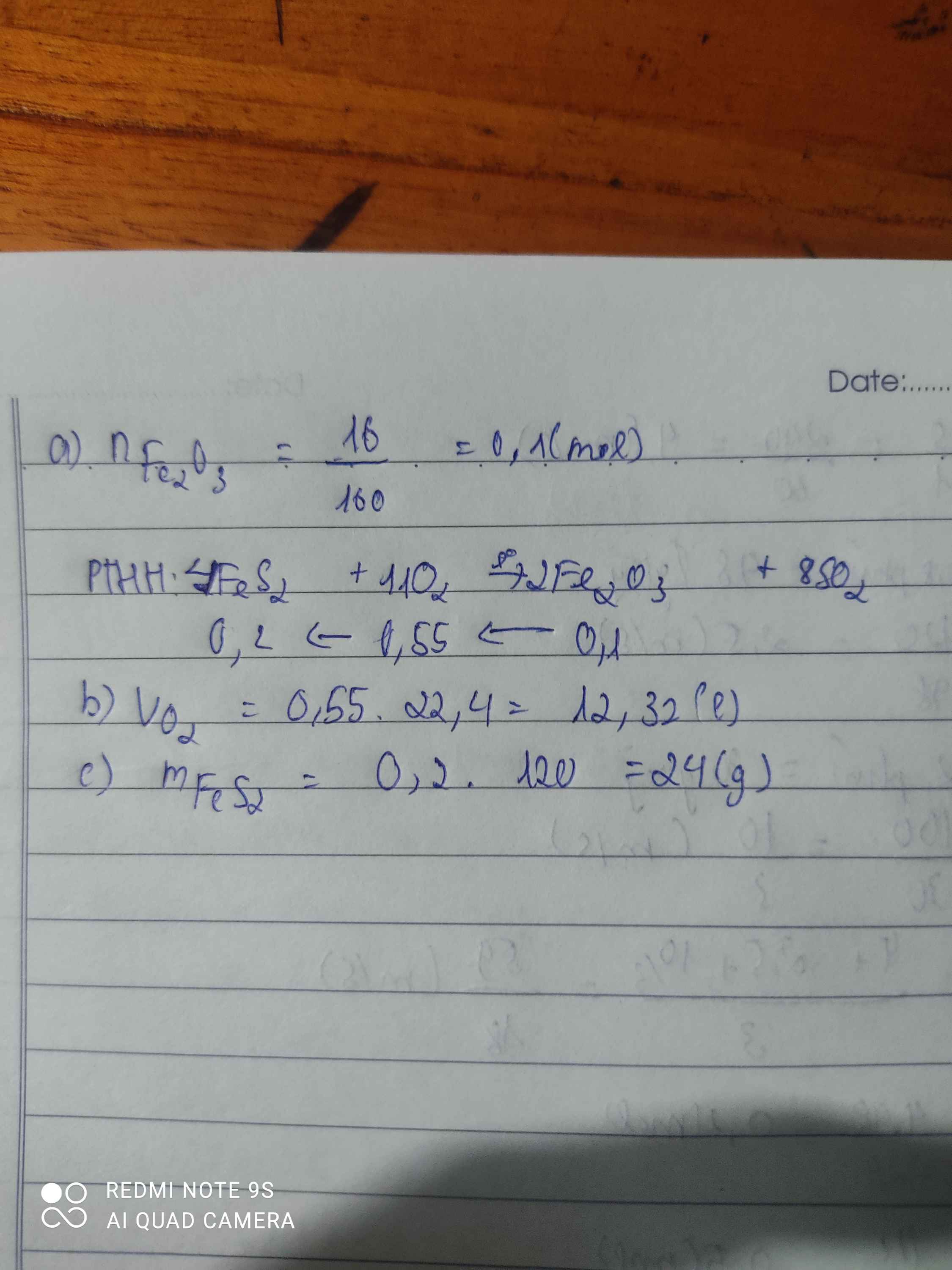Tính khối lượng hidro và oxi cần tác dụng với nhau để tạo thành 9g H\(_2\)O

Những câu hỏi liên quan
tính thể tích H₂ và thể tích O₂ (đktc) cần tác dụng với nhau để tạo ra được 9g H₂O
\(n_{H_2O}=\dfrac{9}{18}=0,5\left(mol\right)\)
PTHH: 2H2 + O2 --to--> 2H2O
0,5<--0,25<------0,5
=> VH2 = 0,5.22,4 = 11,2 (l)
=> VO2 = 0,25.22,4 = 5,6 (l)
Đúng 3
Bình luận (0)
\(n_{H_2O}=\dfrac{m}{M}=\dfrac{9}{18}=0,5mol\)
\(2H_2+O_2\rightarrow\left(t^o\right)2H_2O\)
0,5 0,25 0,5 ( mol )
\(V_{H_2}=n.22,4=0,5.22,4=11,2l\)
\(V_{O_2}=n.22,4=0,25.22,4=5,6l\)
Đúng 2
Bình luận (1)
nH2O=9:18=0,5(mol)
PTHH : 2H2+O2--->2H2O
0,5<- 0,25<-----0,2(mol)
=> VO2 = 0,25.22,4 =5,6(l)
=>VH2= 0,5 . 22,4= 11,2(l)
Đúng 1
Bình luận (0)
Bài 3.Cho 10,2 gam Al2O3 tác dụng vừa đủ với dung dịch HCl tạo thành Nhôm clorua AlCl3 và H2O.
a)Tính khối lượng HCl cần dùng và khối lượng AlCl3 tạo thành (đktc)
b) Cần bao nhiêu lít khí Oxi (đktc) để khi tác dụng với Al tạo thành lượng Al2O3 ở trên?
( cho Al: 27, H:1, Cl:35,5, O: 16)
a. \(n_{Al_2O_3}=\dfrac{10,2}{102}=0,1\left(mol\right)\)
PTHH : Al2O3 + 6HCl -> 2AlCl3 + 3H2O
0,1 0,6 0,2 ( mol )
\(m_{HCl}=0,6.36,5=21,9\left(g\right)\)
\(m_{AlCl_3}=0,2.133,5=26,7\left(g\right)\)
b.
PTHH : 3O2 + 4Al -> 2Al2O3
0,15 0,1 ( mol)
\(V_{O_2}=0,15.22,4=3,36\left(l\right)\)
Đúng 1
Bình luận (0)
a. \(n_{Al_2O_3}=\dfrac{10,2}{102}=0,1\left(mol\right)\)
PTHH : Al2O3 + 3HCl -> 2AlCl3 + 3H2O
0,1 0,3 0,2 ( mol )
\(m_{HCl}=0,3.36,5=10,95\left(g\right)\)
\(m_{AlCl_3}=0,2.133,5=26,7\left(g\right)\)
b.
PTHH : 3O2 + 4Al -> 2Al2O3
0,15 0,1 ( mol)
\(V_{O_2}=0,15.22,4=3,36\left(l\right)\)
Đúng 0
Bình luận (2)
cho m kim loại kẽm tác dụng với 10,95g HCL tạo thành 13,6g ZnCl\(_2\)và khí H\(_2\)
a) tính khối lượng m
b) tính thể tích thu đc
a: \(Zn+2HCl\rightarrow ZnCl_2+H_2\)
\(n_{HCL}=\dfrac{10.95}{36.5}=0.3\left(mol\right)\)
\(n_{ZnCl_2}=n_{Zn}=\dfrac{13.6}{136}=0.1\left(mol\right)\)
Vì \(\dfrac{n_{Zn}}{1}< \dfrac{n_{HCl}}{2}\)
nên HCl dư
=>Tính theo mol của Zn
\(m_{Zn}=0.1\cdot65=6.5\left(g\right)\)
b: \(n_{H_2}=0.1\left(mol\right)\)
\(V_{H_2}=0.1\cdot22.4=2.24\left(lít\right)\)
Đúng 4
Bình luận (0)
a) \(n_{HCl}=\dfrac{10,95}{36,5}=0,3\left(mol\right)\)
\(n_{ZnCl_2}=\dfrac{13,6}{136}=0,1\left(mol\right)\)
PTHH : Zn + 2HCl -> ZnCl2 + H2
0,1 0,1
Xét tỉ lệ \(\dfrac{0,3}{2}>\dfrac{0,1}{1}\) => HCl dư , ZnCl2 đủ
\(m_{Zn}=0,1.65=6,5\left(g\right)\)
b. \(V_{Zn}=0,1.22,4=2,24\left(l\right)\)
Đúng 2
Bình luận (0)
Tính thể tích khí hidro và oxi (dktc) cần tác dụng với nhau để tạo ra 7,2 gam nước
nH2O = 7,2/18 = 0,4 mol
2H2 + O2 ➝ 2H2O
0,4 0,2 0,4 (mol)
VH2 = 0,4.22,4 = 8,96 lít
VO2 = 0,2.22,4 = 4,48 lít
Đúng 2
Bình luận (0)
cho 2,7g nhôm tác dụng với dung dịch H\(_2\)SO\(_4\), cho 171g muối AL\(_2\)SO\(_4\)VÀ 33,6 l khí hidro. Tính khối lượng H\(_2\)SO\(_4\) đã dùng
\(n_{H_2}=\dfrac{33,6}{22,4}=1,5\left(mol\right)\\ m_{H_2}=1,5.2=3\left(g\right)\)
PTHH : 2Al + H2SO4 -> Al2SO4 + H2
Theo ĐLBTKL
\(m_{Al}+m_{H_2SO_4}=m_{Al_2SO_4}+m_{H_2}\\ \Rightarrow m_{H_2SO_4}=\left(171+3\right)-2,7=171,3\left(g\right)\)
Đúng 3
Bình luận (0)
Em coi lại đề bài nhé! 0,1 mol nhôm không thể tạo ra được 0,5mol muối nhôm sunfat và 1,5 mol khí hidro
Các bạn dưới làm chắc không để ý đề bài!
Đúng 1
Bình luận (0)
pthh: 2Al+3H\(_2\)SO\(_4\)→Al\(_2\)(SO4)\(_3\)+3H\(_2\)↑
nH\(_2=33,6:22,4=1,5\left(mol\right)\)
\(mH_2=1,5.2=3\left(g\right)\)
\(nAl_2\left(SO_4\right)=171:150=1,14\left(mol\right)\)
\(mAl_2\left(SO_4\right)_3=1,14.342=389,88\left(g\right)\)
BTKL : mAl + mH\(_2\)SO\(_4\) = m Al\(_2\)(SO4)\(_3\) + m H\(_2\)
2,7 + mH\(_2\)SO\(_4\) = 389,88 + 3
=> \(mH_2SO_4=\left(389,88+3\right)-2,7=390,18\left(g\right)\)
Đúng 0
Bình luận (1)
Tính thể tích khí hidro và khí oxi (ở đktc) cần tác dụng với nhau để tạo ra 1,8 gam nước.
Cho FeS_2 tác dụng với O_2 thì thu được Fe_2O_3 và SO_2 sau p.ưa, Viết PTHH của p.ư trên?b, Tìm thể tích oxi ở (đktc) cần sử dụng biết sau p.ư thu được 16g Fe_2O_3?c, Xác định khối lượng FeS_2 đã sử dụng
Đọc tiếp
Cho FeS\(_2\) tác dụng với O\(_2\) thì thu được Fe\(_2\)O\(_3\) và SO\(_2\) sau p.ư
a, Viết PTHH của p.ư trên?
b, Tìm thể tích oxi ở (đktc) cần sử dụng biết sau p.ư thu được 16g Fe\(_2\)O\(_3\)?
c, Xác định khối lượng FeS\(_2\) đã sử dụng
4FeS+7O2-to>2Fe2O3+4SO2
0,2----0,35------0,1 mol
n Fe2O3=\(\dfrac{16}{160}\)=0,1 mol
=>VO2=0,35.22,4=7,84l
=>m FeS2=0,2.120=24g
Đúng 1
Bình luận (1)
Hòa tan hoàn toàn 0,56g sắt bằng dung dịch H\(_2\)SO\(_4\) loãng 19,6 % vừa đủ
a, Viết phương trình hóa học
b, Tính khối lượng muối tạo thành và thể tích khí hidro sinh ra (đktc)
c, Cần bao nhiêu gam dung dịch H\(_2\)SO\(_4\) nói trên để hòa tan sắt
a) \(Pt:Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
b) \(n_{Fe}=\dfrac{0,56}{56}=0,01mol\)
Theo pt: \(n_{FeSO_4}=n_{Fe}=0,01mol\)
\(\Rightarrow m_{FeSO_4}=0,01.152=1,52g\)
Theo pt: \(n_{H_2}=n_{Fe}=0,01mol\)
\(\Rightarrow V_{H_2}=0,01.22,4=0,224lít\)
c) \(Theopt:nH_2SO_4=n_{Fe}=0,01mol\)
\(\Rightarrow m_{H_2SO_4}=0,01.98=0,98g\)
\(\Rightarrow m_{ddH_2SO_4}=\dfrac{0,98.100}{19,6}=5g\)
Đúng 1
Bình luận (0)
Cho Natri tác dụng đủ với 14,4g nước thu được hợp chất Bazơ và khí Hiđro.
a. Tính thể tích khí Hidro tạo thành ở Đktc?
b. Tính khối lượng Natri cần dùng ?
Tính khối lượng Bazơ tạo thành sau phản ứng?
\(n_{H_2O}=\dfrac{14,4}{18}=0,8mol\)
\(2Na+2H_2O\rightarrow2NaOH+H_2\)
0,8 0,8 0,8 ( mol )
\(m_{Na}=0,8.23=18,4g\)
\(m_{NaOH}=0,8.40=32g\)
Đúng 1
Bình luận (0)
Số mol của nước là:
nH2O=14,4/18=0,8(mol)
PTHH: Na+H2O→NaOH+1/2H2
0,8 0,8 0,8 0,4 ( mol)
a) Thể tích khí Hidro tạo thành(ĐKTC) là:
VH2=0,4*22,4= 8,96(l)
b) Khối lượng Natri là:
mNa=0,8*23 =18,4(g)
Khối lượng Bazơ tạo thành sau phản ứng là:
mNaOH=0,8*40=32(g)
Đúng 0
Bình luận (0)