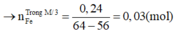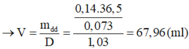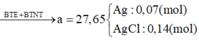Cho 2.8g Fe phản ứng với lượng dư dung dịch HCl thu đc V (1) khí ở đkc . Tìm V

Những câu hỏi liên quan
cho 11 2 gam fe tác dụng vừa đủ với dung dịch hcl. Sau phản ứng thu được V lít khí H2 ở đktc. Tìm V? Tìm khối lượng của FeCl2 tạo ra sau phản ứng? Tìm khối lượng của HCl tham gia?
\(n_{Fe} =\dfrac{11,2}{56} = 0,2(mol)\\ \)
Fe + 2HCl → FeCl2 + H2
0,2.....0,4.........0,2........0,2..............(mol)
Vậy :
V = 0,2.22,4 = 4,48(lít)
\(m_{FeCl_2} = 0,2.127=25,4(gam)\)
\(m_{HCl} = 0,4.36,5 = 14,6(gam)\)
Đúng 3
Bình luận (1)
PTHH: Fe+2HCl → FeCl2+H2
a, nFe=m:M=11,2:56=0,2 mol
Theo PTHH, nFe=nH2=0,2 mol
VH2=n.22,4=0,2.22,4=4,48 lít
b, Theo PTHH, nFeCl2=nFe=0,2
mFeCl2=n.M=0,2.127=25,4 g
c,
Theo PTHH, nHCl=2nFe=0,4 mol
mHCl=n.M=0,4.36,5=14,6 g
Đúng 1
Bình luận (0)
nFe=11,2/56=0,2(mol)
Fe + 2HCl ----->FeCl2 + H2
TPT:nHCl=2.nFe=2.0,2=0,4(mol)
mHCl=0,4.36,5=14,6(g)
TPT:nFeCl2=nFe=0,2(mol)
mFeCl2=0,2.127=25,4(g)
TPT:nH2=nFe=0,2(mol)
vH2=0,2.22,4=4,48(lít)
Đúng 1
Bình luận (0)
Cho hỗn hợp gồm Na và Fe phản ứng hết với dung dịch HCl dư, thu được V lít khí H2. Nếu cho kim loại M (hóa trị II không đổi) có khối lượng bằng một nữa tổng khối lượng Na và Fe tác dụng hết với dung dịch HCl dư cũng thu được V lít khí H2Viết các phương trình phản ứng xảy ra và xác định kim loại M. Biết các khi đo ở cùng điều kiện về nhiệt độ và áp suất
Đặt \(\left\{{}\begin{matrix}n_{Fe}=a\left(mol\right)\\n_{Na}=b\left(mol\right)\end{matrix}\right.\)
PTHH:
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
a--------------------------->a
\(2Na+2HCl\rightarrow2NaCl+H_2\)
b---------------------------->0,5b
Ta có: \(m_M=\dfrac{1}{2}.\left(m_{Fe}+m_{Na}\right)=\dfrac{1}{2}.\left(56a+23b\right)=28a+11,5b\left(g\right)\)
PTHH: \(M+2HCl\rightarrow MCl_2+H_2\)
(a+0,5b)<----------------(a+0,5b)
\(\Rightarrow M_M=\dfrac{28a+11,5b}{a+0,5b}\\ \Rightarrow\dfrac{28a}{a}>M_M>\dfrac{11,5a}{0,5a}\\ \Leftrightarrow28>M_M>23\)
Vậy M là Magie (Mg)
Đúng 1
Bình luận (0)
Cho 5,6 gam Fe tác dụng hoàn toàn với dung dịch HCl,phản ứng tạo ra FeCl2 và khí H2
a,Viết phương trình hóa học của phản ứng
b,tính thể tích H2 thu đc (đkc)
c,đốt cháy hoàn toàn lượng H2 sinh ra thì cần dùng bao nhiêu gam nước,đã dùng dư 5%
BIẾT: Fe=56;H=1;O=16
Fe+2Hcl->FeCl2+H2
0,1---------------------0,1
2H2+O2-to>2H2O
0,1--------------0,1
n Fe=0,1 mol
=>VH2=0,1.22,4=2,24l
c) m H2O=0,1.18.95%=1,71g
Đúng 3
Bình luận (0)
\(n_{Fe}=\dfrac{5,6}{56}=0,1\left(mol\right)\)
PTHH:
Fe + 2HCl ---> FeCl2 + H2
0,1 0,1
2H2 + O2 --to--> 2H2O
0,1 0,1
\(\rightarrow\left\{{}\begin{matrix}V_{H_2}=0,1.22,4=2,24\left(l\right)\\m_{H_2O}=0,1.18.\left(100\%-5\%\right)=1,71\left(g\right)\end{matrix}\right.\)
Đúng 1
Bình luận (0)
nFe = 5,6 : 56 = 0,1 (mol)
pthh : Fe + 2HCl -> FeCl2 + H2
0,1 0,1
=> VH2 = 0,1 . 22,4 = 2,24 (l)
PTHH : 2H2O -đp--> 2H2 + O2
0,1 0,1
nH2O(tt) = 95% nH2O(lt)
=> nH2O(tt) = 95% . 0,1 = 0,097(mol)
=>mH2O = 0,097 . 18 = 1,746 (G)
Đúng 0
Bình luận (0)
1) cho 22g hỗn hợp gồm Al, Fe vào 200ml dung dịch HCl ư, sau phản ứng thu đc 200ml dung dịch B và 17,92l khí H2. Bt lượng HCL dùng dư 20% so với lượng phản ứng. Tính % khối lượng mỗi KL trog hỗn hợp A và CM các chất tan trog dung dịch B2) cho 100ml dung dịch gồm NaCO3 0,5M và NaHCO3 0,4M tác dụng vs 100ml dung dịch HCl 2M, sau phản ứng thu đc V lít khí CO2 và dung dịch X. tính V và CM chất tan trog dung dịch X
Đọc tiếp
1) cho 22g hỗn hợp gồm Al, Fe vào 200ml dung dịch HCl ư, sau phản ứng thu đc 200ml dung dịch B và 17,92l khí H2. Bt lượng HCL dùng dư 20% so với lượng phản ứng. Tính % khối lượng mỗi KL trog hỗn hợp A và CM các chất tan trog dung dịch B
2) cho 100ml dung dịch gồm NaCO3 0,5M và NaHCO3 0,4M tác dụng vs 100ml dung dịch HCl 2M, sau phản ứng thu đc V lít khí CO2 và dung dịch X. tính V và CM chất tan trog dung dịch X
Cho 29,6 g hỗn hợp Cu và Fe tác dụng vừa đủ với dung dịch HCl 1M thì thu được 7,437 Lít khí (đkc). a. Tính khối lượng mỗi kim loại trong hỗn hợp b. Tính thể tích dung dịch HCl 1M đã dùng . c. Cho dung dịch sau phản ứng tác dụng với dd AgNO3 dư. Tính khối lượng kết tủa trắng silver chloride thu được? (Fe = 56, Cu = 64, Ag = 108, Cl = 35,5) híc cứu vớt e đi mà :<<<<
cho 15,3 gam hỗn hợp gồm al,mg,fe phản ứng dung dịch hcl dư thì thu được 29,5 gam hỗ hợp muối than.thể tích của khí h2 ở đkc thu được là
Gọi số mol H2 là a (mol)
=> nHCl = 2a (mol)
Theo ĐLBTKL: mkim loại + mHCl = mmuối + mH2
=> 15,3 + 36,5.2a = 29,5 + 2a
=> a = 0,2 (mol)
=> VH2 = 0,2.22,4 = 4,48 (l)
Đúng 4
Bình luận (0)
Gọi \(n_{H_2}=a\left(mol\right)\)
PTHH:
2Al + 6HCl ---> 2AlCl3 + 3H2
Mg + 2HCl ---> MgCl2 + H2
Fe + 2HCl ---> FeCl2 + H2
Theo các pthh: \(n_{HCl}=2n_{H_2}=2a\left(mol\right)\)
Áp dụng ĐLBTKL:
\(m_{kl}+m_{HCl}=m_{muối}+m_{H_2}\\ \rightarrow15,3+36,5.2a=29,5+2a\\ \Leftrightarrow a=0,2\left(mol\right)\\ V_{H_2}=0,2.22,4=4,48\left(l\right)\)
Đúng 2
Bình luận (0)
cho 8,1 gam Aluminium vào ống nghiệm chứa dung dịch Sulfulric acid (H2So4), sau phản ứng thì thu đc dung dịch muối Y và V lít khí thoát ra
a) Tính V (đkc)
b) tính khối lượng muối Y thu được sau phản ứng
c) Dùng thể tích khí hydrogen ở trên để khử Copper (II) oxide. Sau phản ứng thu được bao nhiêu gam kim loại ?
2Al + 3H2SO4 -- > Al2(SO4)3 + 3H2
0,3 0,45 0,15 0,45
nAl = 8,1 / 27 = 0,3(mol)
\(VH_2=0,45.22,4=10,08\left(g\right)\)
\(m\left(muối\right)=0,15.342=51,3\left(g\right)\)
\(H_2+CuO\rightarrow Cu+H_2O\)
0,45 0,45
mCu = 0,45 . 64 = 28,8(g)
Đúng 2
Bình luận (3)
Hỗn hợp M gồm Fe, FeO, Fe2O3 nặng 14,16 gam. Chia thành 3 phần đều nhau. Cho dòng khí H2 (dư) đi qua phần 1 (nung nóng) thì thu được 3,92 gam Fe. Cho phần 2 vào lượng dư dung dịch CuSO4 thì thu được 4,96 gam hỗn hợp rắn. Phần 3 được hòa tan vừa hết bởi một lượng tối thiểu V ml dung dịch HCl 7,3% (d1,03g/ml). sau phản ứng thu được dung dịch X. Cho dung dịch X tác dụng với lượng dư dung dịch AgNO3, được a gam kết tủa. Các phản ứng đều xảy ra hoàn toàn Giá trị của V lần lượt là: A. 6,25 và 15,12 B...
Đọc tiếp
Hỗn hợp M gồm Fe, FeO, Fe2O3 nặng 14,16 gam. Chia thành 3 phần đều nhau. Cho dòng khí H2 (dư) đi qua phần 1 (nung nóng) thì thu được 3,92 gam Fe. Cho phần 2 vào lượng dư dung dịch CuSO4 thì thu được 4,96 gam hỗn hợp rắn. Phần 3 được hòa tan vừa hết bởi một lượng tối thiểu V ml dung dịch HCl 7,3% (d=1,03g/ml). sau phản ứng thu được dung dịch X. Cho dung dịch X tác dụng với lượng dư dung dịch AgNO3, được a gam kết tủa. Các phản ứng đều xảy ra hoàn toàn
Giá trị của V lần lượt là:
A. 6,25 và 15,12
B. 67,96 và 14,35
C. 56,34 và 27,65
D . 67,96 và 27,65
Hòa tan hết 2,24 gam bột Fe vào 120 ml dung dịch HCl 1M, thu được dung dịch X. Cho X tác dụng với lượng dư dung dịch AgNO3, sau khi kết thúc các phản ứng thu được V lít khí NO ( sản phẩm khử duy nhất ở đktc) và m gam chất rắn. Giá trị của m và V lần lượt là A. 18,30 và 0,672 B. 17,72 và 0,448 C. 18,30 và 0,224 D. 17,22 và 0,22
Đọc tiếp
Hòa tan hết 2,24 gam bột Fe vào 120 ml dung dịch HCl 1M, thu được dung dịch X. Cho X tác dụng với lượng dư dung dịch AgNO3, sau khi kết thúc các phản ứng thu được V lít khí NO ( sản phẩm khử duy nhất ở đktc) và m gam chất rắn. Giá trị của m và V lần lượt là
A. 18,30 và 0,672
B. 17,72 và 0,448
C. 18,30 và 0,224
D. 17,22 và 0,22