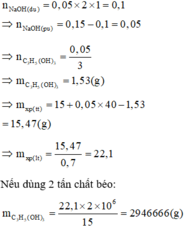Chia 19,8 gam Zn(OH)2 thành hai phần bằng nhau:
a. Cho 150 ml dung dịch H2SO4 1M vào phần một. Tính khối lượng muối tạo thành.
b. Cho 150 ml dung dịch NaOH 1M vào phần hai. Tính khối lượng muối tạo thành.

Những câu hỏi liên quan
Chia dung dịch H3PO4 thành 3 phần bằng nhau: - Trung hòa phần một vừa đủ bởi 300 ml dung dịch NaOH 1M. - Trộn phần hai với phần ba rồi cho tiếp vào một lượng dung dịch NaOH như đã dùng ở phần một, cô cạn thu được m gam muối. Giá trị m là: A. 16,4 gam. B. 24,0 gam C. 26,2 gam D. 27,2 gam
Đọc tiếp
Chia dung dịch H3PO4 thành 3 phần bằng nhau:
- Trung hòa phần một vừa đủ bởi 300 ml dung dịch NaOH 1M.
- Trộn phần hai với phần ba rồi cho tiếp vào một lượng dung dịch NaOH như đã dùng ở phần một, cô cạn thu được m gam muối. Giá trị m là:
A. 16,4 gam.
B. 24,0 gam
C. 26,2 gam
D. 27,2 gam
Đáp án C
Trung hòa phần 1 vừa đủ bởi NaOH:

Đúng 0
Bình luận (0)
chia 15,6g Al(OH)3 làm hai phần bằng nhau
a/ cho 200ml dung dịch H2SO4 1M vào phần I. Tính khối lượng muối tạo thành
b/ cho 50ml dung dịch NaOH 1M vào phần II. Tính khối lượng muối tạo thành
nAl(OH)3= 15.6/78=0.2 mol
PI : nH2SO4= 0.2 mol
2Al(OH)3 + 3H2SO4 --> Al2(SO4)3 + 6H2O
Bđ: 0.2_________0.2
Pư : 1/15________0.2_________1/15
Kt: 2/15_________0___________1/15
mAl2(SO4)3= 1/15*342= 22.8g
PII:
nNaOH = 0.05 mol
NaOH + Al(OH)3 --> NaAlO2 + 2H2O
Bđ: 0.05_____0.2
Pư: 0.05_____0.05______0.05
Kt: 0________0.15______0.05
mNaAlO2= 0.05*82=4.1g
Đúng 0
Bình luận (0)
a) \(n_{H_2SO_4}=0,2\times1=0,2\left(mol\right)\)
\(m_{Al\left(OH\right)_3}=\frac{1}{2}\times15,6=7,8\left(g\right)\)
\(\Rightarrow n_{Al\left(OH\right)_3}=\frac{7,8}{78}=0,1\left(mol\right)\)
PTHH: 2Al(OH)3 + 3H2SO4 → Al2(SO4)3 + 6H2O
Theo PT: \(n_{Al\left(OH\right)_3}=\frac{2}{3}n_{H_2SO_4}\)
Theo bài: \(n_{Al\left(OH\right)_3}=\frac{1}{2}n_{H_2SO_4}\)
Vì \(\frac{1}{2}< \frac{2}{3}\) ⇒ H2SO4 dư
Theo PT: \(n_{Al_2\left(SO_4\right)_3}=\frac{1}{2}n_{Al}=\frac{1}{2}\times0,1=0,05\left(mol\right)\)
\(\Rightarrow m_{Al_2\left(SO_4\right)_3}=0,05\times342=17,1\left(g\right)\)
b) \(n_{NaOH}=0,05\times1=0,05\left(mol\right)\)
\(m_{Al\left(OH\right)_3}=\frac{1}{2}\times15,6=7,8\left(g\right)\)
\(\Rightarrow n_{Al\left(OH\right)_3}=\frac{7,8}{78}=0,1\left(mol\right)\)
PTHH: Al(OH)3 + NaOH → NaAlO2 + 2H2O
Theo PT: \(n_{Al\left(OH\right)_3}=n_{NaOH}\)
Theo bài : \(n_{Al\left(OH\right)_3}=2n_{NaOH}\)
Vì \(2>1\) → Al(OH)3 dư
Theo Pt: \(n_{NaAlO_2}=n_{NaOH}=0,05\left(mol\right)\)
\(\Rightarrow m_{NaAlO_2}=0,05\times82=4,1\left(g\right)\)
Đúng 0
Bình luận (0)
Cho một lượng dư muối Na2CO3 vào 200 ml dung dịch H2SO4 1M thấy thoát ra một chất khí, cho toàn bộ khí đó hấp thụ hoàn toàn vào 98g dung dịch KOH 40%. Tính khối lượng muối tạo thành
\(PTHH:Na_2CO_3+H_2SO_4\rightarrow Na_2SO_4+H_2O+CO_2\\ CO_2+KOH\rightarrow KHCO_3\\ \Rightarrow n_{H_2SO_4}=n_{CO_2}=1\cdot0,2=0,2\left(mol\right)\\ m_{KOH}=\dfrac{98\cdot40\%}{100\%}=39,2\left(g\right)\\ \Rightarrow n_{KOH}=\dfrac{39,2}{56}=0,7\left(mol\right)\)
Do đó sau phản ứng, KOH dư
\(\Rightarrow n_{KHCO_3}=n_{CO_2}=0,2\left(mol\right)\\ \Rightarrow m_{KHCO_3}=0,2\cdot100=20\left(g\right)\)
Đúng 3
Bình luận (1)
Một hỗn hợp gồm Cụ và Fe có tổng khối lượng là 12 gam được cho vào 400 ml dung dịch HCl 1M sau phản ứng thu được 6,4 gam chất rắn dung dịch A và thể tích lít khí
a) tính thành phần phần trăm về khối lượng mỗi kim loại ban đầu
b) lấy 360 ml dung dịch KOH 1M cho vào dung dịch A Tính khối lượng kết tủa tạo thành
cho 44,2g hỗn hợp muối Na2SO3 và K2SO3 phản ứng với dung dịch H2SO4 20% thu được 6,72 lít khí (đktc)
a tính khối lượng dung dịch H2SO4 đủ phản ứng
b tính C% của dung dịch tạo thành sau phản ứng
c dẫn khí sinh ra vào 500 ml dd Ba ( OH )2 1M tính khối lượng muối thu được sau phản ứng
a, \(Na_2SO_3+H_2SO_4\rightarrow Na_2SO_4+SO_2+H_2O\)
\(K_2SO_3+H_2SO_4\rightarrow K_2SO_4+SO_2+H_2O\)
Ta có: \(n_{SO_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
Theo PT: \(n_{H_2SO_4}=n_{SO_2}=0,3\left(mol\right)\)
\(\Rightarrow m_{ddH_2SO_4}=\dfrac{0,3.98}{20\%}=147\left(g\right)\)
b, Ta có: 126nNa2SO3 + 158nK2SO3 = 44,2 (1)
Theo PT: \(n_{SO_2}=n_{Na_2SO_3}+n_{K_2SO_3}=0,3\left(2\right)\)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}n_{Na_2SO_3}=0,1\left(mol\right)\\n_{K_2SO_3}=0,2\left(mol\right)\end{matrix}\right.\)
Có: m dd sau pư = 44,2 + 147 - 0,3.64 = 172 (g)
\(\Rightarrow\left\{{}\begin{matrix}C\%_{Na_2SO_3}=\dfrac{0,1.126}{172}.100\%\approx7,33\%\\C\%_{K_2SO_3}=\dfrac{0,2.158}{172}.100\%\approx18,37\%\end{matrix}\right.\)
c, \(n_{Ba\left(OH\right)_2}=0,5.1=0,5\left(mol\right)\)
\(\Rightarrow\dfrac{n_{SO_2}}{n_{Ba\left(OH\right)_2}}=0,6< 1\) → Pư tạo BaSO3.
PT: \(SO_2+Ba\left(OH\right)_2\rightarrow BaSO_3+H_2O\)
\(n_{BaSO_3}=n_{SO_2}=0,3\left(mol\right)\Rightarrow m_{BaSO_3}=0,3.217=65,1\left(g\right)\)
Đúng 1
Bình luận (0)
Bài 2: Cho 4,8 gam hỗn hợp Fe và Cu tác dụng vừa đủ với dung dịch H2SO4 đặc nóng thu được 2,24 lít khí SO2 (đktc).
a. Tính thành phần phần trăm khối lượng mỗi kim loại trong hỗn hợp ban đầu?
b. Cho SO2 thu được vào 150 ml dung dịch KOH 1M. Tính khối lượng muối thu được?
a) n Fe = a(mol) ; n Cu = b(mol)
=> 56a + 64b = 4,8(1)
n SO2 = 2,24/22,4 = 0,1(mol)
Bảo toàn e :
3n Fe + 2n Cu = 2n SO2
<=> 3a + 2b = 0,2(2)
Từ (1)(2) suy ra a = b = 0,04
%m Fe = 0,04.56/4,8 .100% = 46,67%
%m Cu = 100% -46,67% = 53,33%
b)
n KOH = 0,15
Ta có :
1 < n KOH / n SO2 = 0,15/0,1 = 1,5 < 2 nên muối sinh ra là Na2SO3(x mol) và NaHSO3(y mol)
2NaOH + SO2 $\to$ Na2SO3 + H2O
NaOH + SO2 $\to$ NaHSO3
Theo PTHH :
n SO2 = a + b = 0,1
n NaOH = 2a + b = 0,15
Suy ra a= 0,05 ; b = 0,05
m muối = 0,05.126 + 0,05.104 = 11,5 gam
Đúng 2
Bình luận (1)
Bài 2 :
- Gọi số mol Fe và Cu lần lượt là a, b mol
Ta có : mhh = mFe + mCu = 56a + 64b = 4,8
Bte : 3a + 2b = 0,2
=> a = b =0,04mol
a, Ta có : mFe =n.M = 2,24g ( 46,7% )
=> %Cu = 53,3%
b, Ta thấy sau phản ứng thu được K+, SO3-2 xmol, HSO3- y mol
BtS : x + y = 0,1
BTĐT : 2x + y = 0,15
=> x =y = 0,05 mol
=> mM = mK2SO3 + mKHSO3 = 13,9g
Đúng 1
Bình luận (0)
Đun nóng 15 gam chất béo trung tính với 150 ml dung dịch NaOH 1M. Phải dùng 50 ml dung dịch H2SO4 1M để trung hòa NaOH dư. Khối lượng xà phòng (chứa 70% khối lượng muối natri của axit béo) thu được từ 2 tấn chất béo trên là A. 2062 kg B. 2266 kg C. 2946 kg D. 3238 kg
Đọc tiếp
Đun nóng 15 gam chất béo trung tính với 150 ml dung dịch NaOH 1M. Phải dùng 50 ml dung dịch H2SO4 1M để trung hòa NaOH dư. Khối lượng xà phòng (chứa 70% khối lượng muối natri của axit béo) thu được từ 2 tấn chất béo trên là
A. 2062 kg
B. 2266 kg
C. 2946 kg
D. 3238 kg
Chia chất rắn X gồm Al, Zn và Cu làm 2 phần bằng nhau:+ Cho phần 1 vào dung dịch NaOH dư, sau phản ứng thấy còn 12,4 g rắn.+ Cho phần 2 vào 500 ml dung dịch AgNO3 1M sau phản ứng được dung dịch Y và m gam chất rắn Z. Thêm dung dịch NaOH dư vào dung dịch Y, lọc lấy kết tủa nung đến khối lượng không đổi được 8 gam chất rắn T. Tính m: A. 60 B. 66 C. 58 D. 54
Đọc tiếp
Chia chất rắn X gồm Al, Zn và Cu làm 2 phần bằng nhau:
+ Cho phần 1 vào dung dịch NaOH dư, sau phản ứng thấy còn 12,4 g rắn.
+ Cho phần 2 vào 500 ml dung dịch AgNO3 1M sau phản ứng được dung dịch Y và m gam chất rắn Z. Thêm dung dịch NaOH dư vào dung dịch Y, lọc lấy kết tủa nung đến khối lượng không đổi được 8 gam chất rắn T. Tính m:
A. 60
B. 66
C. 58
D. 54
cho m gam Zn vào 150 ml dung dịch HCL vừa đủ . Sau phản ứng thu được 3,36 lít khí H2 (đktc)
a) Tìm m b) Tính nồng độ mol của dung dịch HCL c) Tính khối lượng muối tạo thành\(n_{H_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\\ PTHH:Zn+2HCl\rightarrow ZnCl_2+H_2\\ n_{ZnCl_2}=n_{Zn}=n_{H_2}=0,15\left(mol\right);n_{HCl}=2.0,15=0,3\left(mol\right)\\ a,m=m_{Zn}=0,15.65=9,75\left(g\right)\\ b,C_{MddHCl}=\dfrac{0,3}{0,15}=0,2\left(l\right)\\ c,m_{ZnCl_2}=0,15.136=20,4\left(g\right)\)
Đúng 3
Bình luận (0)