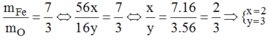1)Tính theo công thức hóa họca) tính % khối lượng của các nguyên tố trong hợp chất:NANO3,K2CO3,AL(OH)3,SO3,FE2O3b)Một hợp chất khí X có tỉ khối đối với hidro là 8,5.Hãy xác định công thức hóa học của X biết hợp chất khí X có thành phần theo khối lượng là 82,35%N và 17,65%H2) Cho 11,2 gam Fe tác dụng với dung dịch HCL. Sản phẩm tạo thành là sắt (II) clorua và khí hidro.a) Viết phương trình hóa học xảy rab) tính thể tích khí H2 thu được ở điều kiện tiêu chuẩnc) tính khối lượng HCL đã phản ứngd) kh...
Đọc tiếp
1)Tính theo công thức hóa học
a) tính % khối lượng của các nguyên tố trong hợp chất:NANO3,K2CO3,AL(OH)3,SO3,FE2O3
b)Một hợp chất khí X có tỉ khối đối với hidro là 8,5.Hãy xác định công thức hóa học của X biết hợp chất khí X có thành phần theo khối lượng là 82,35%N và 17,65%H
2) Cho 11,2 gam Fe tác dụng với dung dịch HCL. Sản phẩm tạo thành là sắt (II) clorua và khí hidro.
a) Viết phương trình hóa học xảy ra
b) tính thể tích khí H2 thu được ở điều kiện tiêu chuẩn
c) tính khối lượng HCL đã phản ứng
d) khối lượng FeCl2 tạo thành
3) Cho 6 gam Mg phản ứng 2,24 lít khí oxi(đktc).Sau phản ứng thu được magie oxit(MgO)
a) viết phườn trình hóa học
b) tính khối lượng MgO được tạo thành
4) Cho phản ứng: 4Al+3O2-)2Al2O3. Biết cos,4.10^23 nguyên tử Al phản ứng.
a) Tính thể tích khí O2 đã tham gia phản ứng ở đktc. Từ đó tính thể tích không khí cần dùng. Biết khí oxi chiếm 1/5 thể tích của không khí.
b) Tính khối lượng Al2O3 tạo thành
#m.n_giúp_mk_nha_mk_đang_cần_gấp