Hòa tan 28,6g Na2CO3.10H2O vào lượng H2O vừa đủ để tạo 200ml dd.Tính C%,CM.Biết D=1,05g/mol.

Những câu hỏi liên quan
Hòa tan 28.6 gam Na2CO3.10H2O vào lượng nước vừa đủ để tạo thành 200ml dd Tính nồng độ mol, nồng độ % của dung dịch thu được biết d=1.05
\(n_{Na_2CO_3.10H_2O}=\dfrac{28,6}{286}=0,1\left(mol\right)\)
=> nNa2CO3 = 0,1(mol)
=> \(C_M=\dfrac{0,1}{0,2}=0,5M\)
mdd sau pư = 1,05.200 = 210 (g)
=> \(C\%=\dfrac{0,1.106}{210}.100\%=5,05\%\)
Đúng 3
Bình luận (0)
Hòa tan hoàn toàn 28,6g Na2CO3 ngậm 10nước vào 1 lượng nước vừa đủ tạo 200ml dung dịch.Tính Cm,C%? D=1,05g/ml?
Bạn ơi bạn muốn tính gì?? Câu hỏi cụ thể ra nó chung quá mk ko bt???
Đúng 0
Bình luận (0)
Hòa tan hoàn toàn 28,6 g Na2CO3.10H2O vào đủ để tạo thành 200 ml dd. Xác định nồng độ % và nồng độ mol của dd. Biết dd này có KLR D = 1,05g/ml
$n_{Na_2CO_3} = n_{Na_2CO_3.10H_2O} = \dfrac{28,6}{286} = 0,1(mol)$
$C_{M_{Na_2CO_3}} = \dfrac{0,1}{0,2} = 0,5M$
$m_{dd} = D.V = 200.1,05 = 210(gam)$
$C\%_{Na_2CO_3} = \dfrac{0,1.106}{210}.100\% = 5,05\%$
Đúng 3
Bình luận (0)
\(m_{dd}\)=1,05.200=210 g
=>C%dd =\(\dfrac{28,6}{210}\) .100% =13,62%
Mặt khác : 200ml=0,2l
Mct=23.2+12+16.3+10.(1.2+16)=286 (M nguyên tử khối )
=>nct=\(\dfrac{28,6}{286}\) =0,1 mol
=>CM=\(\dfrac{0,1}{0,2}\) =0,5M
Đúng 1
Bình luận (0)
1)Hòa tan 28,6g Na2CO3.10H2O vào 1 lượng nước vừa đủ đẻ tạo thành 200ml dd, tính a)C% của dung dịch thu được
b)Cm của dd thu được?(biết Dm=1,05g/ml)
2)khử hoàn toàn 2,4g hh gồm CuO và FexOy bằng khí H2 thu được 1,76g kim loại. Hòa tan kim loại đó vào dung dịch HCl dư thu 0,448l H2(đktc).Xác định công thức của oxit sắt.
Hòa tan 0,5mol Na2CO3.10H2O vào 200g H2O tính nồng độ phần trăm, nồng độ mol và khối lượng riêng của dung dịch
tan hoàn toàn 12,4 g na2o và 200ml dd vừa đủ ( d hcl=1,05g/mol) a,viết pthh , b,tính nồng độ mol của đ hcl đã dùng ,c, tính nồng độ phần trăm của đ sau phản ứng
\(n_{Na_2O}=\dfrac{12,4}{62}=0,2mol\\ a,Na_2O+H_2O\rightarrow2NaOH\\ NaOH+HCl\rightarrow NaCl+H_2O\\ n_{HCl}=n_{NaCl}=0,2.2=0,4mol\\ b,C_{M_{HCl}}=\dfrac{0,4}{0,2}=2M\\ c,m_{ddNaCl}=200.1,05+12,4=222,4g\\ C_{\%NaCl}=\dfrac{0,4.58,5}{222,4}\cdot100=10,52\%\)
Đúng 3
Bình luận (0)
a,Cho 100ml dung dịch HCL 0,1M(Khối lượng riêng d1,05g/mol) hòa tan vừa đủ m gam kim loại M cho ra dung dịch có khối lượng là 105,11 gam.Xác định m và M.b,cho vào 200 ml dung dịch HCL 0,1M một lượng 0,26 gam Zn và 0,28 gam Fe,sau đó thêm tiếp vào dung dịch này kim loại M nói trên cho đến khi thu được dung dịch có chứa 2 muối và chất rắn B có khối lượng lớn khối lượng M đã cho vào là 0,218 gam.Tính khối lượng của M đã sử dụng biết các phản ứng xảy ra hoàn toàn.
Đọc tiếp
a,Cho 100ml dung dịch HCL 0,1M(Khối lượng riêng d=1,05g/mol) hòa tan vừa đủ m gam kim loại M cho ra dung dịch có khối lượng là 105,11 gam.Xác định m và M.
b,cho vào 200 ml dung dịch HCL 0,1M một lượng 0,26 gam Zn và 0,28 gam Fe,sau đó thêm tiếp vào dung dịch này kim loại M nói trên cho đến khi thu được dung dịch có chứa 2 muối và chất rắn B có khối lượng lớn khối lượng M đã cho vào là 0,218 gam.Tính khối lượng của M đã sử dụng biết các phản ứng xảy ra hoàn toàn.
a, \(n_{HCl}=0,1.0,1=0,01\left(mol\right)\)
\(m_{ddHCl}=100.1,05=105\left(g\right)\)
BTNT H, có: \(n_{H_2}=\dfrac{1}{2}n_{HCl}=0,005\left(mol\right)\)
Theo ĐLBT KL, có: mM + m dd HCl = m dd sau pư + mH2
⇒ mM = 105,11 + 0,005.2 - 105 = 0,12 (g) = m
Giả sử M có hóa trị n.
BT e, có: n.nM = 2nH2 \(\Rightarrow n_M=\dfrac{2n_{H_2}}{n}=\dfrac{0,01}{n}\left(mol\right)\)
\(\Rightarrow M_M=\dfrac{0,12}{\dfrac{0,01}{n}}=12n\left(g/mol\right)\)
Với n = 2, MM = 24 (g/mol) là thỏa mãn.
Vậy: M là Mg.
b, Ta có: \(\left\{{}\begin{matrix}n_{Zn}=\dfrac{0,26}{65}=0,004\left(mol\right)\\n_{Fe}=\dfrac{0,28}{56}=0,005\left(mol\right)\end{matrix}\right.\)
\(n_{HCl}=0,2.0,1=0,02\left(mol\right)\)
PT: \(Zn+2HCl\rightarrow ZnCl_2+H_2\)
____0,004_____0,008__0,004 (mol)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
0,005____0,01____0,005 (mol)
⇒ nHCl (dư) = 0,02 - 0,008 - 0,01 = 0,002 (mol)
Sau pư trong dd còn: \(\left\{{}\begin{matrix}ZnCl_2:0,004\left(mol\right)\\FeCl_2:0,005\left(mol\right)\\HCl:0,002\left(mol\right)\end{matrix}\right.\)
- Cho Mg vào đến khi thu dd có chứa 2 muối (MgCl2 và ZnCl2):
PT: \(Mg+2HCl\rightarrow MgCl_2+H_2\)
__0,001______0,002 (mol)
\(Mg+FeCl_2\rightarrow MgCl_2+Fe\)
0,005_____0,005___________0,005 (mol)
\(Mg+ZnCl_2\rightarrow MgCl_2+Zn\)
x_________x_______________x (mol)
B gồm: 0,005 (mol) Fe và x (mol) Zn
Mà: mB - mMg = 0,218
⇒ 0,005.56 + 65x - (0,001 + 0,005 + x).24 = 0,218
⇒ x = 0,002 (mol)
⇒ mMg pư = (0,001 + 0,005 + 0,002).24 = 0,192 (g)
Đúng 2
Bình luận (0)
Cân 10,6g muối
N
a
2
C
O
3
cho vào cốc chia độ. Rót vào cốc khoảng vài chục ml nước cất, khuấy cho muối tan hết. Sau đó rót thêm nước vào cốc cho đủ 200ml. Ta được dung dịch
N
a
2
C
O
3
có khối lượng riêng là 1,05g/ml. Hãy tính nồng độ phần trăm và nồng độ mol của dung dịch vừa pha chế.
Đọc tiếp
Cân 10,6g muối N a 2 C O 3 cho vào cốc chia độ. Rót vào cốc khoảng vài chục ml nước cất, khuấy cho muối tan hết. Sau đó rót thêm nước vào cốc cho đủ 200ml. Ta được dung dịch N a 2 C O 3 có khối lượng riêng là 1,05g/ml. Hãy tính nồng độ phần trăm và nồng độ mol của dung dịch vừa pha chế.
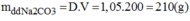
Nồng độ phần trăm của dung dịch pha chế:
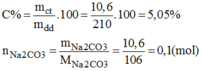
Nồng độ mol của dung dịch:
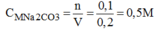
Đúng 0
Bình luận (0)
Mọi người giúp vs ạ B1 Hòa tan 4g NaOH vào H2O tạo thành dung dịch A. Trung hòa hoàn toàn dung dịch A bằng 200ml dd H2SO4 nồng độ x (M). Tính xB2 Đốt cháy 0.36g bột Mg trong không khí thu đc chất rắn A. Hòa tan hết A trong lượng vừa đủ là 100ml dd hcl loãng thu đc dd A1 . tính nồng độ mol của dd hcl đã dùng và nồng độ muối trong dung dich A
Xem chi tiết
B1:
2NaOH+H2SO4\(\rightarrow\)Na2SO4+2H2O
nNaOH=\(\frac{4}{40}=0.1\)mol
=>nH2SO4=\(\frac{1}{2}\)nNaOH=0.05 mol
=>CM=\(\frac{n_{H2SO42}}{V}\)=\(\frac{0.05}{200}\)=2,5.10-4 (M)
Đúng 0
Bình luận (0)
B2:
Mg+\(\frac{1}{2}\)O2\(\underrightarrow{t^0}\)MgO (1)
MgO+2HCl\(\rightarrow\)MgCl2+H2O (2)
nMg(1)=\(\frac{0,36}{24}=0,015mol\)
=>nMgO(1)=0,015=nMgO(2)
nHCl(2)=2nMgO(2)=0,03mol
=>CM(HCl)=\(\frac{n_{HCl}}{V}=\frac{0,03}{100}=3.10^{-4}M\)
Đúng 0
Bình luận (0)



























