Nung nóng hỗn hợp A gồm Al và Fe304( khôg có không khí)
Hỗn hợp thu dc sau pư tác dụng dd KOH dc 6,72l đktc
Nếu sản phẩm tác dụng với HCl dư dc 26,88l h2 đktc. Tìm khối lượng mỗi chất trong A
Help me, please
Nung Al và F e 3 O 4 (không có không khí, phản ứng xảy ra hoàn toàn) thu được hỗn hợp A. Nếu cho A tác dụng với dung dịch KOH dư thì thu được 0,672 lít khí (đktc). Nếu cho A tác dụng với H 2 S O 4 đặc, nóng dư được 1,428 lít SO2 duy nhất (đktc). % khối lượng Al trong hỗn hợp ban đầu là:
A. 33,69%
B. 26,33%
C. 38,30%
D. 19,88%

Số mol S O 2 = 1,5x + 0,03 = 0,06375→ x = 0,0225 mol
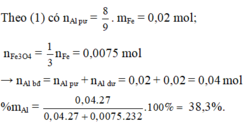
⇒ Chọn C.
Nung hỗn hợp A gồm Fe và S đến phản ứng hoàn toàn rồi để nguội thu được hỗn hợp B. Nếu cho B vào dd HCl dư, thu được 2,24 lít khí C (đktc) có dC/H2=13. Tính khối lượng mỗi chất trong hỗn hợp ban đầu.
Gọi số mol Na, Zn là a, b
=> 23a + 65b = 14,3
n H2=\(\dfrac{2,24}{22,4}\)=0,1 mol
- Nếu Zn tan hết
2Na + 2H2O --> 2NaOH + H2
a-------------------->a---->0,5a
2NaOH + Zn --> Na2ZnO2 + H2
2b<----b-------------------->b
->\(\left\{{}\begin{matrix}2b\text{≤}a\\0,5a+b=14,3\end{matrix}\right.\) loại
=> Zn không tan hết => NaOH hết
PT:2Na + 2H2O --> 2NaOH + H2
a------------------->a---->0,5a
2NaOH + Zn --> Na2ZnO2 + H2
\ a--------------------------->0,5a
=> 0,5a + 0,5a = 0,1
=> a = 0,1
=> mNa = 0,1.23 = 2,3 (g)
=> mZn = 14,3 - 2,3 = 12(g)
PTP. ứng:
Fe+S----> FeS
Fe+ 2HCl--> FeCl2+H2
x x (mol)
FeS+ 2HCl--> FeCl2+ H2S
y y (mol)
Gọi n H2 và H2S trong C lần lượt là x và y mol, ta có hpt:
x+y=0.1
(2x+32y)/2(x+y)=13
--> x=0.02, y=0.08
--> tổng m Fe+n FeS= n Fe tỏng A=x+y=0.1 mol
m Fe=0.1.56=5.6 (g)
Nung Al và Fe3O4 (không có không khí, phản ứng xảy ra hoàn toàn) thu được hỗn hợp A.
- Nếu cho A tác dụng với dung dịch KOH dư thì thu được 0,672 lít khí (đktc).
- Nếu cho A tác dụng vói H2SO4 đặc, nóng dư được 1,428 lít SO2 duy nhất (đktc).
Phần trăm khối lượng Al trong hỗn hợp ban đầu là:
A. 33,69%
B. 26,33%
C. 38,30%
D. 19,88%
Đáp án C
8 Al + 3 Fe 3 O 4 → t o 4 Al 2 O 3 + 9 Fe
Vì phản ứng xảy ra hoàn toàn và hòa tan A vào dung dịch NaOH thu được khí nên A gồm Fe, A12O3 và Al dư.

Cho m gam hỗn hợp Al và Fe tác dụng vừa đủ với dd HCl 2M, thu đc dd muối A và 1,456lits H2 ở đktc. Mặt khác cho lượng hỗn hợp trên tác dụng với dd NaOH dư, thu đc 1,12 g chất rắn không tan.
a) tính khối lượng và% khối lượng mỗi chất trong hỗn hợp nói trên
b) tính khối lượng muối thu đc trong ddA
a) \(2Al+6HCl\rightarrow2AlCl_3+3H_2\left(1\right)\\ Fe+2HCl\rightarrow FeCl_2+H_2\left(2\right)\\ 2Al+2NaOH+2H_2O\rightarrow2NaAlO_2+3H_2\)
Cho hỗn hợp tác dụng với NaOH, chất rắn không tan là Fe
=> mFe= 1,12 (g) \(\Rightarrow n_{Fe}=0,02\left(mol\right)\)
Ta có: \(n_{H_2\left(2\right)}=n_{Fe}=0,02\left(mol\right)\)
=> \(n_{H_2\left(1\right)}=\Sigma n_{H_2}-n_{H_2\left(2\right)}=0,065-0,02=0,045\left(mol\right)\)
\(\Rightarrow n_{Al}=\dfrac{2}{3}n_{H_2\left(1\right)}=0,03\left(mol\right)\)
\(\Rightarrow m_{Al}=0,03.27=0,81\left(g\right)\)
\(\Rightarrow\%m_{Al}=41,97\%,\%m_{Fe}=58,03\%\)
b) \(m_{FeCl_2}=0,02.127=2,54\left(g\right)\\ m_{AlCl_3}=0,03.133,5=4,005\left(g\right)\)
Cho 1 lượng hỗn hợp Mg, Al tác dụng với dung dịch HCl dư thu được 10,08l khí H2 (đktc). Mặt khác. cũng lượng hỗn hợp trên tác dụng với dung dịch NaOH dư thì thu được 6,72l H2 (đktc). Tính khối lượng của mỗi kim loại trong hỗn hợp ban đầu đã dùng.
- Xét TN2:
\(n_{H_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
PTHH: 2Al + 2NaOH + 2H2O --> 2NaAlO2 + 3H2
0,2<--------------------------------0,3
=> mAl = 0,2.27 = 5,4 (g)
- Xét TN1:
\(n_{H_2}=\dfrac{10,08}{22,4}=0,45\left(mol\right)\)
PTHH: 2Al + 6HCl --> 2AlCl3 + 3H2
0,2------------------->0,3
Mg + 2HCl --> MgCl2 + H2
0,15<------------------0,15
=> mMg = 0,15.24 = 3,6 (g)
Nung nóng một thời gian hỗn hợp A gồm Al và một oxit sắt (Giả sử chỉ xảy ra phản ứng khử oxit thành kim loại) được m gam hỗn hợp B. Chia hỗn hợp B thành hai phần bằng nhau. Cho phần thứ nhất tác dụng hoàn toàn với dd KOH dư thu được 10,08 lít khí đktc và có 29,52 gam chất rắn không tan. Hòa tan hoàn toàn phần thứ 2 bằng dd H2SO4 đặc nóng, dư được 19,152 lít khí SO2 (sản phẩm khử duy nhất, đktc) và dung dịch C. Cho dd C tác dụng hoàn toàn với dd NH3 dư, lấy toàn bộ lượng kết tủa tạo thành đem nung đến khối lượng không đổi thu được 65,07 gam chất rắn. Xác định công thức của oxit sắt và tính giá trị của m.


Qui đổi ½ hh B gồm Al (x mol), Fe (y mol), O (z mol)

=> mB = 2 (mAl + mFe + mO) = 102,78g
Gọi công thức của oxit sắt là FeaOb

=> Fe2O3
Đốt nóng hỗn hợp X gồm bột Fe và S trong điều kiện không có không khí thu được hỗn hợp rắn A. Cho A tác dụng với một lượng dư dung dịch HCl thu được sản phẩm khí Y có tỷ khối hơi so với H2 là 13. Lấy 2,24lit khí Y(đktc) đem đốt cháy rồi cho sản phẩm cháy đó qua 100ml dung dịch H2O2 5,1% (khối lượng riêng d = 1gam/ml), sau phản ứng thu được dung dịch B. Cho rằng các phản ứng xảy ra hoàn toàn
a. Viết các phương trình hóa học xảy ra
b. Xác định thành phần phần trăm theo khối lượng của mỗi chất trong hỗn hợp X
c. Xác định nồng độ phần trăm các chất trong hỗn hợp B
Nung 37,92g KMnO4 ở nhiệt độ cao thu dc 34,72 g chất rắn A và khí B
a, Tính khối lg các chất có trong A
b, Trộn khí B với khí H2 để tạo hỗn hợp nổ . Hỏi phải dùng bn g Kim loại Al cho tác dụng với dd HCl dử để có dc khí H2 tạo ra hỗn hợp nổ mạnh nhất
\(2KMnO_4\underrightarrow{^{^{t^0}}}K_2MnO_4+MnO_2+O_2\)
\(0.2.................0.1...........0.1...........0.1\)
Bảo toàn khối lượng :
\(m_{O_2}=37.92-34.72=3.2\left(g\right)\)
\(n_{O_2}=\dfrac{3.2}{32}=0.1\left(mol\right)\)
\(m_{KMnO_4\left(dư\right)}=37.92-0.2\cdot158=6.32\left(g\right)\)
\(m_{K_2MnO_4}=0.1\cdot197=19.7\left(g\right)\)
\(m_{MnO_2}=0.1\cdot87=8.7\left(g\right)\)
\(b.\)
Để hỗn hợp nổ mạnh nhất thì H2 phản ứng với O2 theo tỉ lệ 2 : 1
\(2H_2+O_2\underrightarrow{^{^{t^0}}}2H_2O\)
\(0.2......0.1\)
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
\(\dfrac{2}{15}...........................0.2\)
\(m_{Al}=\dfrac{2}{15}\cdot27=3.6\left(g\right)\)
Cho 6 gam hỗn hợp X gồm Al , Fe, Zn , Mg ( trong đó Fe chiếm a% về khối lượng ) tác dụng với dd HCl dư thu được 1,85925 l khí H2 (đktc) . Nếu cho 6 g hỗn hợp X tác dụng hết với Cl2 dư thì thu được 12,39 g hỗn hợp muối . Tìm a
Mọi người giúp mình với ạ:((
Coi hỗn hợp X gồm R ( có hoá trị n - a mol) và Fe (b mol)
$\Rightarrow Ra + 56b = 6$
$2R + 2nHCl \to 2RCl_n + nH_2$
$Fe + 2HCl \to FeCl_2 + H_2$
Theo PTHH : $n_{H_2} = 0,5an + b = \dfrac{1,85925}{22,4} = 0,083(mol)(1)$
$2R + nCl_2 \xrightarrow{t^o} 2RCl_n$
$2Fe + 3Cl_2 \xrightarrow{t^o} 2FeCl_3$
$m_{Cl_2} = m_{muối} - m_X = 12,39 - 6 = 6,39(gam)$
$n_{Cl_2} = 0,5an + 1,5b = 0,09(2)$
Từ (1)(2) suy ra : an = 0,138 ; b = 0,014
$\%m_{Fe} = a\% = \dfrac{0,014.56}{6}.100\% = 13,07\%$