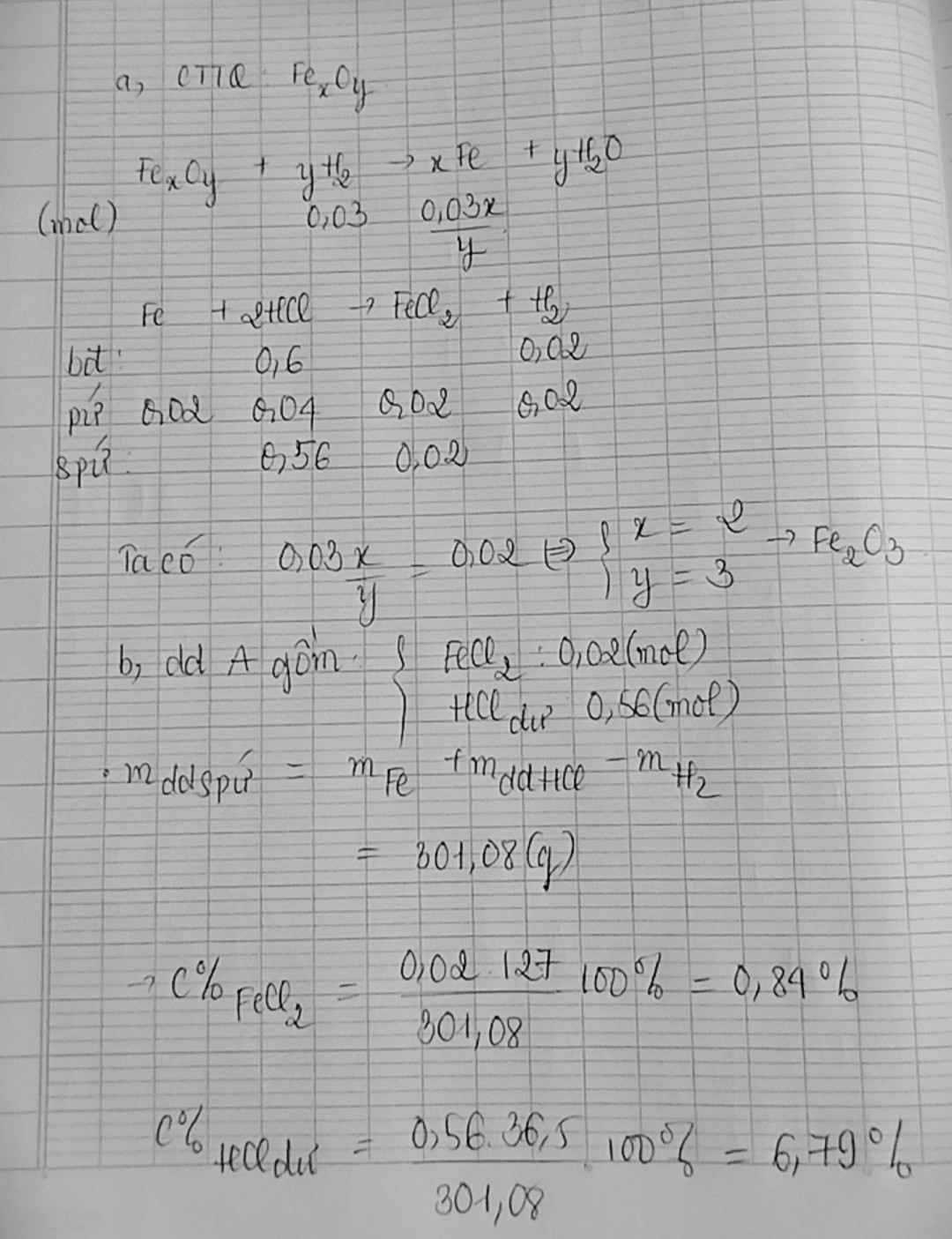Dùng CO dư để khử hoàn tòan m gam bột sắt oxit (FexOy) dẫn tòan bộ lượng khí sinh ra đi thật chậm qua 1 lít dung dịch ba(OH)2 0,1M thì vừa đủ và thu được 9,85gam kết tủa. Mặt khác hòa tan tòan bộ m gam bột sắt oxit trên bằng dd HCl dư rồi cô cạn thì thu được 16,25gam muối khan. m có giá trị là bao nhiêu gam? Và công thức oxit (FexOy)

Những câu hỏi liên quan
Dùng CO dư để khử hoàn toàn m g bột sắt oxit(FexOy) thành sắt, dẫn toàn bộ lượng khí sinh ra đi thật chậm qua 1 lít dd Ba(OH)2 0.1 M thì phản ứng vừ đủ và thu được 9.85 g kết tủa. Mặt khác hòa tan toàn bộ sắt kim loại thu được ở trên bằng dd HCl dư rồi cô cạn thì thu được 12.7 g muối khan . công thức sắt oxit(FexOy)
a)
Khí sinh ra là CO2 :
CO+ Oto→CO2
nBa(OH)2= 0,1 mol
nBaCO3=9,85\197=0,05(mol)
Ta có 2 trường hợp:
TH1: Tạo 1 muối trung hòa
Ba(OH)2+ CO2→ BaCO3↓+H2O
_________0,05____0,05
⇒nCO2= 0,05 ⇒nO(FexOy)= 0,05 (1)
TH2: Tạo 2 muối
Ba(OH)2+ CO2→ BaCO3↓+H2O
0,1_____0,1______0,1
CO2+ BaCO3+H2O→ Ba(HCO3)2
0,05___0,05
⇒nCO2= 0,1+0,05= 0,15 mol ⇒nO(FexOy)= 0,15 (2)
PTHH:
Fe+ 2HCl→ FeCl2+H2↑
nFeCl2=12,7\127=0,1(mol)
⇒ nFe= 0,1 mol
Vậy với nO= 0.05; nFe= 0,1⇒ x : y= 2:1 (loại)
với nO=0,15; nFe= 0,1⇒ x: y= 2:3 hay CTHH: Fe2O3
Đúng 0
Bình luận (0)
\(\left\{{}\begin{matrix}n_{Ba\left(OH\right)2}=0,1\left(mol\right)\\n_{BaCO3}=\frac{9,85}{197}=0,05\left(mol\right)\end{matrix}\right.\)
=> 1 phần kết tủa tan
\(Ba\left(OH\right)_2+CO_2\rightarrow BaCO_3+H_2O\)
\(n_{CO2\left(KT\right)}=n_{Ba\left(OH\right)2}=0,1\left(mol\right)\)
Số mol BaCO3 bị hoà tan: 0,1-0,05= 0,05 mol
\(BaCO_3+CO_2+H_2O\rightarrow Ba\left(HCO_3\right)_2\)
\(\Rightarrow n_{CO2\left(hoa.tan.kt\right)}=n_{BaCO3\left(bi.tan\right)}=0,05\left(mol\right)\)
\(\Rightarrow\Sigma n_{CO2}=0,1+0,05=0,15\left(mol\right)\)
\(CO+O\rightarrow CO_2\)
\(\Rightarrow n_{oxit}=0,15\left(mol\right)\)
Mặt khác:
\(n_{FeCl2}=\frac{12,7}{127}=0,1\left(mol\right)=n_{Fe}\)
\(\Rightarrow n_{Fe}:n_O=0,1:0,15=2:3\)
Vậy oxit sắt là Fe2O3
Đúng 0
Bình luận (0)
để khử hoàn toàn m gam một oxit sắt (FexOy) phải dùng vừa đủ 0,672 lít (đktc) khí H2. Khi đem toàn bộ lượng sắt thu được hòa tan vào 300g dung dịch HCl 7,3% (dư) thì thu được 0,448 lít (đktc) khí H2 và dung dịch A.
a/ Tìm công thức hóa học của oxit sắt trên
b/ Tính nồng độ phần trăm cái chất tan trong dung dịch A
1/ Dùng khí CO để khử 8 g CuO người ta thu được sản phẩm khí.Dẫn toàn bộ sản phẩm khí vào 198,24 ml dd KOH 10%(D = 1,17g/ml).Hãy tính thể tích khí CO đã dùng(đkc) và khối lượng muối sinh ra. 2/ Lấy tòan bộ khí khi cho 45 gam CaCO3 hòa tan hòan tòan trong 200 ml dd HCl vào 500 ml dung dịch NaOH 0,4 M . Xác định muối thu được sau phản ứng.
Dẫn khí CO dư đi qua ống sứ đựng bột oxit sắt nung nóng. Dẫn hết khí sinh ra vào dung dịch Ca(OH)2, thu được 8 gam kết tủa. Hòa tan hết lượng Fe thu được ở trên bằng dung dịch H2SO4 loãng, dư thì thoát ra 1,344 lít H2 (đktc). Công thức oxit sắt đem dùng là
$CO + O_{oxit} \to CO_2$
$CO_2 + Ca(OH)_2 \to CaCO_3 + H_2O$
$n_{O(oxit)} = n_{CaCO_3} = \dfrac{8}{100} = 0,08(mol)$
$Fe + H_2SO_4 \to FeSO_4 + H_2$
$n_{Fe} = n_{H_2} = \dfrac{1,344}{22,4} = 0,06(mol)$
Ta có :
$n_{Fe} : n_O = 0,06 : 0,08 = 3 : 4$
Vậy oxit là $Fe_3O_4$
Đúng 3
Bình luận (0)
Công thức oxit sắt có dạng: \(Fe_xO_y\)
\(Fe_xO_y+yCO\rightarrow xFe+yCO_2\uparrow\)
\(Fe+H_2SO_4\rightarrow FeSO_4+H_2\uparrow\)
\(\Rightarrow n_{Fe}=n_{H_2}=\dfrac{1,344}{22,4}=0,06\left(mol\right)\)
\(CO_2+Ca\left(OH\right)_2\rightarrow CaCO_3\downarrow+H_2O\)
\(\Rightarrow n_{CO}=n_{CO_2}=n_{CaCO_3}=0,08\left(mol\right)\)
\(\Rightarrow n_{O\left(Fe_xO_y\right)}=n_{O\left(CO_2\right)}-n_{O\left(CO\right)}=2n_{CO_2}-n_{CO}=0,08\left(mol\right)\)
\(\Rightarrow n_{Fe}:n_O=0,06:0,08=3:4\)
\(\Rightarrow Fe_3O_4\)
Đúng 1
Bình luận (0)
\(Co+\left\{{}\begin{matrix}Fe:amol\\O:bmol\end{matrix}\right.\)\(\rightarrow\left[{}\begin{matrix}Fe\rightarrow H_2SO_4\\Co_2\rightarrow Ca\left(OH\right)_2\rightarrow caCo_3\end{matrix}\right.\)
\(\cdot m\downarrow=m_{CaCo_3}=8\Rightarrow n_{CaCo_3}=n_{Co_2}=\dfrac{8}{100}=0,08\)
\(\Rightarrow n_O=n_{CO}=n_{CO_2}=0,08\)
\(\cdot Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
0,06 0,06
\(n_{H_2}=\dfrac{1,344}{22,4}=0,06\Rightarrow n_{Fe}=n_{H_2}=0,06\)
\(\Rightarrow\dfrac{n_{Fe}}{n_O}=\dfrac{0,06}{0,08}=\dfrac{3}{4}\Rightarrow Fe_3O_4\)
Đúng 0
Bình luận (0)
Khử hoàn toàn 4,06 gam một oxit kim loại bằng khí CO ở nhiệt độ cao thành kim loại. Dẫn toàn bộ khí sinh ra vào bình đựng dung dịch Ca(OH)2 (dư) tạo thành 7,00 gam kết tủa. Nếu lấy lượng kim loại sinh ra hòa tan hết vào dung dịch HCl (dư) thì thu được 1,176 lít khí H2 (đktc). Công thức của oxit kim loại là A. FeO. B. CrO. C. Fe2O3. D. Fe3O4
Đọc tiếp
Khử hoàn toàn 4,06 gam một oxit kim loại bằng khí CO ở nhiệt độ cao thành kim loại. Dẫn toàn bộ khí sinh ra vào bình đựng dung dịch Ca(OH)2 (dư) tạo thành 7,00 gam kết tủa. Nếu lấy lượng kim loại sinh ra hòa tan hết vào dung dịch HCl (dư) thì thu được 1,176 lít khí H2 (đktc). Công thức của oxit kim loại là
A. FeO.
B. CrO.
C. Fe2O3.
D. Fe3O4
Gọi công thức oxit ban đầu là MxOy.
Có phản ứng khử hoàn toàn oxit MxOy thành kim loại:
![]()
Dẫn khí CO2 sinh ra hấp thụ vào dung dịch Ca(OH)2 dư:
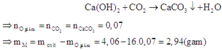
Cần lưu ý: Hóa trị của kim loại M trong oxit ban đầu và hóa trị của M trong sản phẩm của phản ứng giữa M với axit HCl có thể khác nhau.
Do đó ta gọi n là hóa trị của M thể hiện khi phản ứng với axit HCl.
![]()
Áp dụng định luật bào toàn mol electron, ta có:
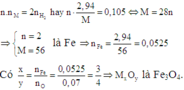
Đáp án D.
Đúng 1
Bình luận (0)
Khử hoàn toàn 4,06 gam một oxit kim loại bằng CO ở nhiệt độ cao thành kim loại. Dẫn toàn bộ khí sinh ra vào bình đựng dung dịch Ca(OH)2 dư, thấy tạo thành 7 gam kết tủa. Nếu lấy lượng kim loại sinh ra hòa tan hết vào dung dịch HCl dư thì thu được 1,176 lít khí H2 (đktc). Xác định công thức oxit kim loại.
⇒mO trong oxit=1,12
⇒m kim loại trong oxit=2,94
nH2=0,0525
gọi hóa trị của M khi td với axit là n
M+nHCl--> MCln+n/2 H2
nM=0,105/n
M=2,94.n/0,105=28n
⇒M=56, n=2 (Fe)
trong oxit nFe=0,0525
nO=0,07
⇒ct oxit là Fe3O4
Đúng 1
Bình luận (0)
Khử hoàn toàn 4,06 gam một oxit kim loại bằng CO ở nhiệt độ cao thành kim loại. Dẫn toàn bộ khí sinh ra vào bình đựng Ca(OH)2 dư, thấy tạo thành 7 gam kết tủa. Nếu lấy lượng kim loại sinh ra hòa tan hết vào dung dịch HCl dư thu được 1,176 lít khí (đkc). Xác định công thức oxit kim loại. A. CuO B. Fe2O3 C. Fe3O4 D. ZnO
Đọc tiếp
Khử hoàn toàn 4,06 gam một oxit kim loại bằng CO ở nhiệt độ cao thành kim loại. Dẫn toàn bộ khí sinh ra vào bình đựng Ca(OH)2 dư, thấy tạo thành 7 gam kết tủa. Nếu lấy lượng kim loại sinh ra hòa tan hết vào dung dịch HCl dư thu được 1,176 lít khí (đkc). Xác định công thức oxit kim loại.
A. CuO
B. Fe2O3
C. Fe3O4
D. ZnO
khử hoàn toàn 4,06 một oxit kim loại bằng CO ở nhiệt đọ cao thành kim loại .Dẫn toàn bộ khí sinh ra vào bình đựng Ca(OH)2 dư , thấy tạo thành 7g kết tủa .nếu lấy lượng kim loại sinh ra hòa tan hết vào dung dịch HCl dư thì thu được 1,176 lít khí H2 (đktc).xác định công thức phân tử oxit kim loại .
Gọi CT của oxit cần tìm là RxOy
RxOy+yCO→xR+yCO2 (1)
CO2+Ca(OH)2→CaCO3+H2O (2)
Vì Ca(OH)2 dư nên nCO2=n↓=0,07 mol
Theo PTHH (1), nO trong oxit=nCO2=0,07 mol
→mO trong oxit=0,07.16=1,12 g
→mR trong oxit=4,06−1,12=2,94 g
+) Cho kim loại R tác dụng với dung dịch HCl
PTHH: 2R+2nHCl→2RCln+nH2 (3)
Ta có: nH2=0,0525 mol
Theo (3), nR=\(\dfrac{2}{n}\)H2=\(\dfrac{0,105}{n}\)
→\(\dfrac{0,105}{n}R\)=2,94→R=28n
Chỉ có cặp nghiệm duy nhất thỏa mãn:
\(\left\{{}\begin{matrix}n=2\\R=56\left(Fe\right)\end{matrix}\right.\)
→nFe=0,0525 mol
Khi đó ta có: \(\dfrac{x}{y}:\dfrac{nFe}{nO}:\dfrac{0,0525}{0,07}=\dfrac{3}{4}\)
Vậy CT của oxit kim loại cần tìm là: Fe3O4
Đúng 3
Bình luận (0)
Lau 8 (20): Khử hoàn toàn 16.2g một oxit kim loại bằng khí CO vừa đu ở nhiệt độ cao thành kim loại. Dẫn toàn bộ khi sinh ra vào dung dịch Ca(OH)2 dư thấy tạo ra 20g kết tủa. Nếu lấy lượng kim loại sinh ra hòa tan hết vào dung dịch HCl dư thì thu được 4,48 lít khí H2 (dktc). Xác định công thức oxit kim loại.
\(n_{CaCO_3}=\dfrac{20}{100}=0,2\left(mol\right)\)
Gọi CTHH của oxit là XaOb
PTHH: XaOb + bCO --to--> aX + bCO2
\(\dfrac{0,2}{b}\)<---------------\(\dfrac{0,2a}{b}\)<-0,2
Ca(OH)2 + CO2 --> CaCO3 + H2O
0,2<------0,2
=> \(M_{X_aO_b}=a.M_X+16b=\dfrac{16,2}{\dfrac{0,2}{b}}=81b\left(g/mol\right)\)
=> \(\dfrac{a}{b}=\dfrac{65}{M_X}\)
\(n_{H_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
PTHH: 2X + 2nHCl --> 2XCln + nH2
\(\dfrac{0,4}{n}\)<---------------------0,2
=> \(\dfrac{0,2a}{b}=\dfrac{0,4}{n}\)
=> \(\dfrac{13}{M_X}=\dfrac{0,4}{n}\) => \(M_X=\dfrac{65}{2}n\left(g/mol\right)\)
- Nếu n = 1 => Loại
- Nếu n = 2 => MX = 65 (g/mol)
=> X là Zn
\(\dfrac{x}{y}=1\) => CTHH: ZnO
- Nếu X = 3 => Loại
Vậy CTHH của oxit là ZnO
Đúng 1
Bình luận (0)
Gọi oxit kim loại là MxOy.
MxOy + yCO → xM + yCO2
nCaCO3 = 0,2 mol → nCO2 = 0,2 mol
Số mol của oxi có trong oxit = số mol CO = số mol CO2 = 0,2 mol
→ khối lượng của oxi có trong oxit là 0,2.16 = 3,2 gam
mO + mM = 16,2 gam → mM = 13 gam
2M + 2nHCl → 2MCln + nH2
0,2.2/n ← 0,2 mol
mM = 13 gam, nM = 0,4/n mol
→ M = 13.n/0,4 = 32,5n
Xét n = 1 → M = 32,5 (loại)
n = 2 → M = 65 → M là Zn
nZn : nO = 1 : 1 → Công thức của oxit là ZnO
Đúng 1
Bình luận (0)