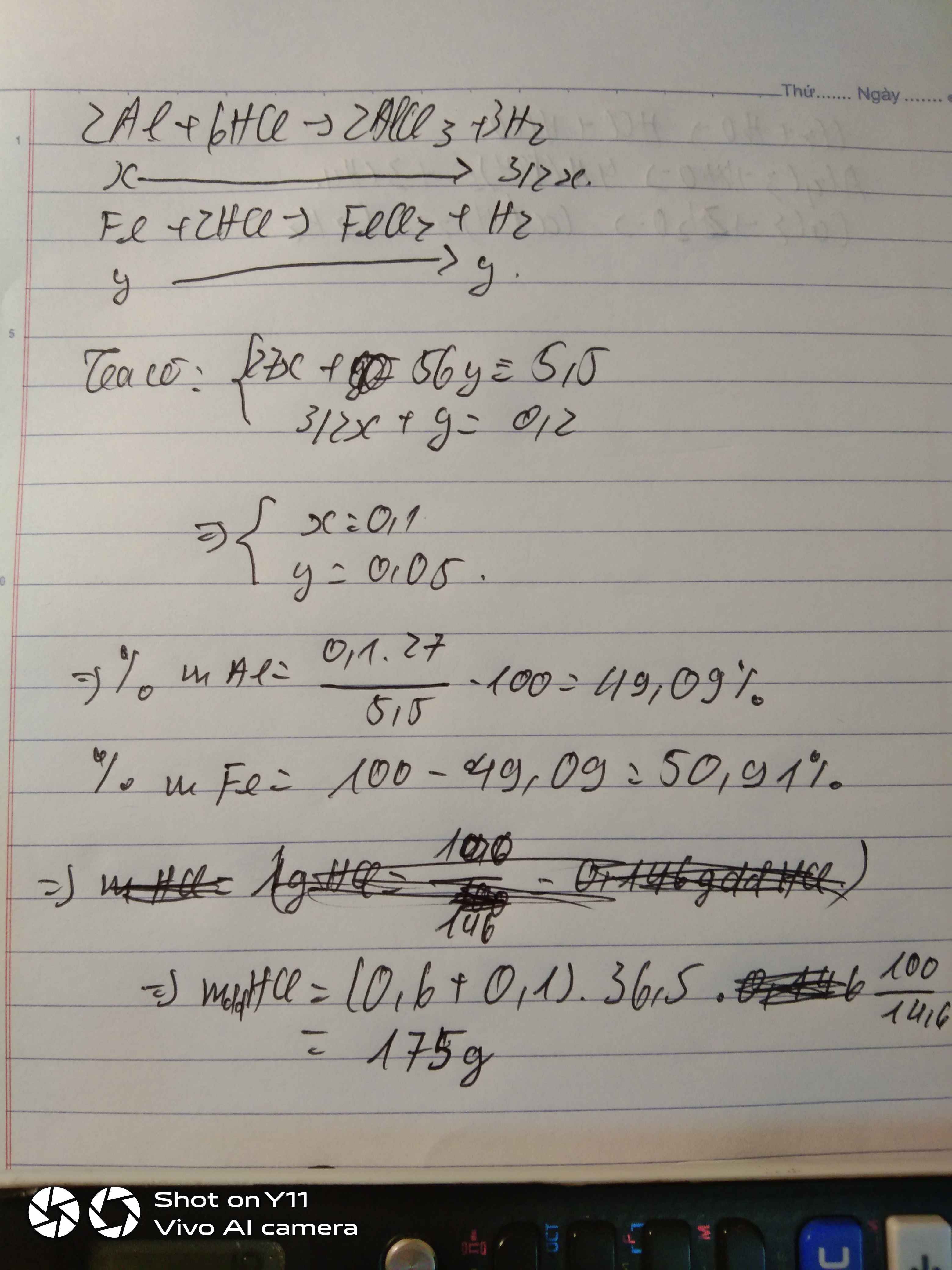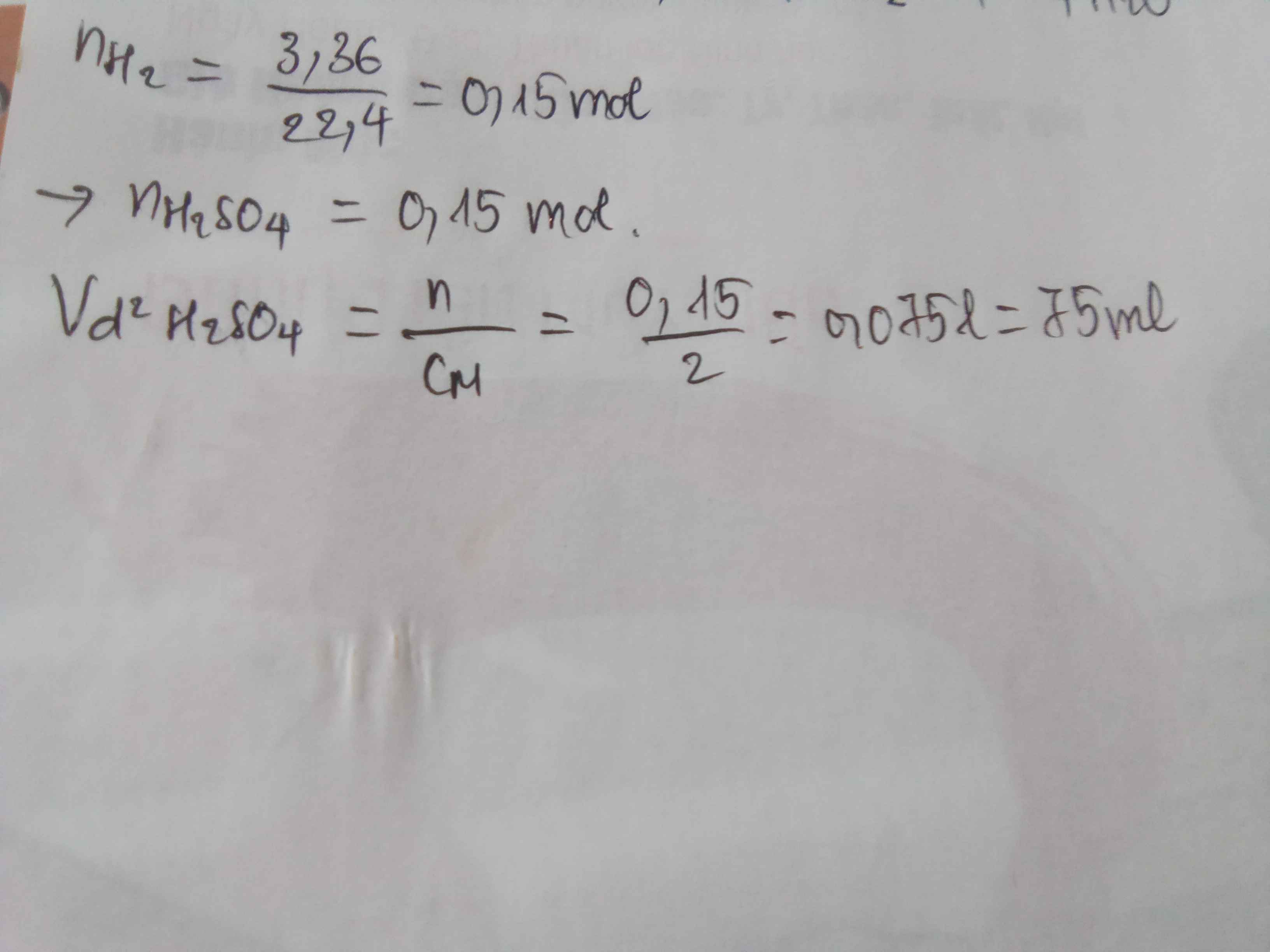Tính khối lượng Fe và thể tích dung dịch HCl cần dùng để diều chế được 8,96 lít Hidro.

Những câu hỏi liên quan
9.1 . Hòa tan 11,0 gam hỗn hợp bột 2 kim loại Al và Fe vào dd HCl dư thì thu được 8,96 lít H2 ở đktc. a. Tìm khối lượng mỗi kim loại. b. Tìm thể tích dung dịch HCl 0,5 M (d=1,2) cần dùng.
Câu 5. Cho 25,55g hỗn hợp gồm Fe và Zn tác dụng vừa đủ với dung dịch HCl 2M thu được 8,96 lít H2 (đktc).
a) Tìm % khối lượng của Fe và Zn có trong hỗn hợp ban đầu.
b) Tính thể tích dung dịch HCl 2M cần dùng.
c) Tính CM của mỗi muối tạo thành sau phản ứng. (Giả sử thể tích không đổi)
a.\(n_{H_2}=\dfrac{V_{H_2}}{22,4}=\dfrac{8,96}{22,4}=0,4mol\)
Gọi \(\left\{{}\begin{matrix}n_{Fe}=x\\n_{Zn}=y\end{matrix}\right.\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
x x ( mol )
\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
y y ( mol )
Ta có:
\(\left\{{}\begin{matrix}56x+65y=25,55\\x+y=0,4\end{matrix}\right.\) \(\Leftrightarrow\left\{{}\begin{matrix}x=0,05\\y=0,35\end{matrix}\right.\)
\(\Rightarrow m_{Fe}=0,05.56=2,8g\)
\(\Rightarrow m_{Zn}=0,35.65=22,75g\)
\(\%m_{Fe}=\dfrac{2,8}{25,55}.100=10,95\%\)
\(\%m_{Zn}=100\%-10,95\%=89,05\%\)
b.\(n_{HCl}=2.0,05+2.0,35=0,8mol\)
\(C_M=\dfrac{n}{V}\Rightarrow V=\dfrac{n}{C_M}=\dfrac{0,8}{2}=0,4l\)
Đúng 1
Bình luận (0)
cho 19,5g kẽm tác dụng với 200ml dung dịch HCL thu được muối clorua và khí hidro
a) tính nồng độ mol dung dịch phản ứng sau
b) tính thể tích khí hidro sinh ra ( đktc)
c) tính khối lượng dung dịch NAOH 20 % cần dùng để trung hòa hết lượng axit trên
200ml = 0,2l
\(n_{Zn}=\dfrac{19,5}{65}=0,3\left(mol\right)\)
Pt : \(Zn+2HCl\rightarrow ZnCl_2+H_2|\)
1 2 1 1
0,3 0,6 0,3 0,3
a) \(n_{ZnCl2}=\dfrac{0,3.1}{1}=0,3\left(mol\right)\)
\(C_{M_{ZnCl2}}=\dfrac{0,3}{0,2}=1,5\left(M\right)\)
b) \(n_{H2}=\dfrac{0,3.1}{1}=0,3\left(mol\right)\)
\(V_{H2\left(dktc\right)}=0,3.22,4=6,72\left(l\right)\)
c) Pt : \(NaOH+HCl\rightarrow NaCl+H_2O|\)
1 1 1 1
0,6 0,6
\(n_{NaOH}=\dfrac{0,6.1}{1}=0,6\left(mol\right)\)
\(m_{NaOH}=0,6.40=24\left(g\right)\)
\(m_{ddNaOH}=\dfrac{24.100}{20}=120\left(g\right)\)
Chúc bạn học tốt
Đúng 1
Bình luận (0)
hòa tan hoàn toàn 5,5 gam hỗn hợp gồm Al, Fe bằng dung dịch HCl vừa đủ thu được 4,48 lít khí hidro dkc
a . tính phần trăm khối lượng mỗi kim loại trong hỗn hợp đồng
b. tính khối lượng dung dịch HCl cần dùng nếu cứ 100 gam dung dịch HCl có chứa 14,6 gam HCl nguyên chất
Gọi \(\left\{{}\begin{matrix}n_{Al}=x\left(mol\right)\\n_{Fe}=y\left(mol\right)\end{matrix}\right.\)
\(n_{H_2}=\dfrac{4,48}{22,4}=0,2mol\)
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
Theo pt: \(\Rightarrow\left\{{}\begin{matrix}3x+y=0,2\\27x+56y=5,5\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}x=\dfrac{19}{470}\\y=\dfrac{37}{470}\end{matrix}\right.\)
\(\%m_{Al}=\dfrac{\dfrac{19}{470}\cdot27}{5,5}\cdot100\%=19,84\%\)
\(\%m_{Fe}=100\%-19,84\%=80,16\%\)
Khối lượng Một mẫu hỗn hợp kim loại K và Al tác dụng với nước dư thu được dung dịch X và 3,36 lít khí hidro tính thể tích dung dịch H2 SO4 2m cần dùng để trung hòa hết dung dịch X ở trên
\(n_{H_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\\ PTHH:2K+2H_2O\rightarrow2KOH+H_2\uparrow\\ Theo.pt:n_{KOH}=2n_{H_2}=2.0,15=0,3\left(mol\right)\)
\(PTHH:2KOH+H_2SO_4\rightarrow K_2SO_4+2H_2O \\ Mol:0,3\rightarrow0,15\\ V_{ddH_2SO_4}=\dfrac{0,15}{2}=0,075\left(l\right)\)
Đúng 5
Bình luận (0)
Khối lượng Một mẫu hỗn hợp kim loại K và ba
tác dụng với nước dư thu được dung dịch X và 3,36 lít khí hidro tính thể tích dung dịch H2 SO4 2m cần dùng để trung hòa hết dung dịch X ở trên
X + nH2O → X(OH)n + n/2 H2.
Ta có: n(H2) = 0,15 mol
→ n(OH-) = 2n (H2) = 0,3 mol
→ n(H+) = 0,3 mol → 2. 2V = 0,3 → V = 0,075 (lít)
Đúng 3
Bình luận (0)
Hòa tan hoàn toàn 11 gam hỗn hợp gồm Fe và Al bằng một lượng dung dịch HCl vừa đủ thu được 8,96 lít H2(đktc). Tính khối lượng mỗi kim loại đã dùng
Gọi nFe = a (mol); nAl = b (mol)
=> 56a + 27b = 11 (1)
nH2 = 8,96/22,4 = 0,4 (mol)
PTHH:
Fe + 2HCl -> FeCl2 + H2
a ---> 2a ---> a ---> a
2Al + 6HCl -> 2AlCl3 + 3H2
b ---> 1,5b ---> b ---> b
=> a + 1,5b = 0,4 (2)
Từ (1)(2) => a = 0,1 (mol); b = 0,15 (mol)
mFe = 0,1 . 56 = 5,6 (g)
mAl = 0,2 . 27 = 5,4 (g)
Đúng 2
Bình luận (0)
THAM KHẢO :
Fe + 2HCl -> FeCl2 + H2 (1)
a) 2Al + 6HCl -> 2AlCl3 + 3H2 (2)
Gọi khối lượng Fe là x(g) (0<x<11) => nFe = x/56 (mol)
Thì mAl là 11-x(g) => nAl = (11-x)/27 (mol)
nH2 = 8,96/22,4 = 0,4 (mol)
Theo PT (1) ta có: nH2 = nFe = x/56 (mol)
Theo PT (2) ta có: nH2 = 3/2 nAl = 3/2 . (11-x)/27 = (11-x)/18 (mol)
Theo đề bài, nH2 thu được là 0,4(mol) nên ta có:
x/56 + (11-x)/18 = 0,4
<=> 18x +56(11-x) = 403,2
<=> x = 5,6 (g)
Do đó: mFe = 5,6(g) => nFe = 5,6/56 = 0,1 (mol)
mAl = 11-5,6 = 5,4(g) => nAl = 5,4/27 = 0,2 (mol)
Phân hủy 24,5 gam Kali clorat. tính thể tích CO2 thu được (đkc) .Tính khối lượng KMnO4 được dùng để thu 2,24 lít CO2(đkc) biết lượng hao hụt khí thu được và 10% .Tính khối lượng Fe và thể tích O2 cần để điều chế 3,48 g Fe304 .Để có lượng O2 trên cần phân hủy bao nhiêu gam KClO3?
a)
\(n_{KClO_3}=\dfrac{24.5}{122.5}=0.2\left(mol\right)\)
\(2KClO_3\underrightarrow{^{^{t^0}}}2KCl+3O_2\)
\(n_{O_2}=\dfrac{3}{2}\cdot0.2=0.3\left(mol\right)\)
\(V_{O_2}=0.3\cdot22.4=6.72\left(l\right)\)
Đúng 4
Bình luận (0)
\(n_{O_2}=\dfrac{2.24}{22.4}=0.1\left(mol\right)\)
\(2KMnO_4\underrightarrow{^{^{t^0}}}K_2MnO_4+MnO_2+O_2\)
\(0.2...............................................0.1\)
\(n_{KMnO_4\left(bđ\right)}=\dfrac{0.2}{90\%}=\dfrac{2}{9}\left(mol\right)\)
\(m_{KMnO_4}=\dfrac{2}{9}\cdot158=35.11\left(g\right)\)
Đúng 3
Bình luận (0)
\(n_{Fe_3O_4}=\dfrac{3.48}{232}=0.015\left(mol\right)\)
\(3Fe+2O_2\underrightarrow{^{^{t^0}}}Fe_3O_4\)
\(0.045....0.03......0.015\)
\(m_{Fe}=0.045\cdot56=2.52\left(g\right)\)
\(V_{O_2}=0.03\cdot22.4=0.672\left(l\right)\)
\(2KClO_3\underrightarrow{^{^{t^0}}}2KCl+3O_2\)
\(0.02......................0.03\)
\(m_{KClO_3}=0.02\cdot122.5=2.45\left(g\right)\)
Đúng 3
Bình luận (0)
cho 11,36 (g) hỗn hợp ZnO và Zn hòa tan hết trong dung dịch HCL 12 phần trăm thì thu được 2,24 lít khí H2 ở (đktc)
a) tính khối lượng mỗi chất trong hỗn hợp ban đầu
b) tính khối lượng dung dịch HCL cần dùng
c) tính thể tích dung dịch HCL cần dùng biết D=1,2 g/ml
Tiếp bài của creeper nhé:
c. Ta có: \(n_{ZnO}=\dfrac{4,86}{81}=0,06\left(mol\right)\)
Theo PT(1): \(n_{HCl}=2.n_{ZnO}=2.0,06=0,12\left(mol\right)\)
Theo PT(2): \(n_{HCl}=2.n_{Zn}=2.0,1=0,2\left(mol\right)\)
=> \(n_{HCl}=0,12+0,2=0,32\left(mol\right)\)
=> \(m_{HCl}=0,32.36,5=11,68\left(g\right)\)
Ta có: \(C_{\%_{HCl}}=\dfrac{11,68}{m_{dd_{HCl}}}.100\%=12\%\)
=> \(m_{dd_{HCl}}=\dfrac{292}{3}\left(g\right)\)
Theo đề, ta có:
\(D=\dfrac{\dfrac{292}{3}}{V_{dd_{HCl}}}=1,2\)(g/ml)
=> \(V_{dd_{HCl}}=81,1\left(ml\right)\)
Đúng 1
Bình luận (1)