Để thu được 19,6g H3PO4 thì cần bao nhiêu g P ?

Những câu hỏi liên quan
Cho 19,6g H3PO4 tác dụng với dd chứa 22g NaOH. Hỏi thu được muối nào ? Tính khối lượng muối thu được
Ta có: \(n_{H_3PO_4}=\dfrac{19,6}{98}=0,2\left(mol\right)\)
\(n_{NaOH}=\dfrac{22}{40}=0,55\left(mol\right)\)
\(\Rightarrow\dfrac{n_{NaOH}}{n_{H_3PO_4}}=2,75\)
⇒ Pư tạo muối Na2HPO4 và Na3PO4.
Gọi số mol 2 muối trên lần lượt là x,y (mol)
BTNT Na và P, có: \(\left\{{}\begin{matrix}x+y=0,2\\2x+3y=0,55\end{matrix}\right.\) \(\Leftrightarrow\left\{{}\begin{matrix}x=0,05\left(mol\right)\\y=0,15\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow m_m=m_{Na_2HPO_4}+m_{Na_3PO_4}=0,05.142+0,15.164=31,7\left(g\right)\)
Bạn tham khảo nhé!
Đúng 1
Bình luận (0)
Cho 20g MgO tác dụng với 19,6g H3PO4. Tính khối lượng các chất thu được sau phản ứng
3MgO +2H3PO4➡ Mg3(PO4)2+3H2O
nMgO=20/(24+16)=0.5 mol
nH3PO4=19.6/(3+31+64)=0.2mol
➡ MgO dư
nMgO phản ứng =(0.2✖ 3)/2=0.3mol
➡ nMgO dư =0.2mol
mMgO dư =0.2❌ 40=8g
nMg3(PO4)2=0.1mol➡ m Mg3(PO4)2=35.7g
Đúng 0
Bình luận (0)
PTHH: \(3MgO+2H_3PO_4-->Mg_3\left(PO_4\right)_2+3H_2O\)
\(n_{MgO}=\dfrac{20}{40}=0,5\left(mol\right)\)
\(n_{H_3PO_4}=\dfrac{19,6}{98}=0,2\left(mol\right)\)
Lập tỉ lệ: \(\dfrac{0,5}{3}>\dfrac{0,2}{2}\)=> MgO dư, H3PO4 p/ứ hết
=> Các chất sau phản ứng MgO, Mg3(PO4)2
=> mMgO(dư) = \(\left(0,5-\dfrac{3}{2}.0,2\right).40=8\left(g\right)\)
\(m_{Mg_3\left(PO_4\right)_2}=\dfrac{1}{2}.0,2.262=26,2\left(g\right)\)
Đúng 0
Bình luận (0)
Để thu được muối photphat trung hoà, cần lấy bao nhiêu ml dung dịch NaOH 1,00M cho tác dụng với 50,0ml H3PO4 0,50M?
Ta có: nH3PO4 = 0,05.0,5 = 0,025(mol)
Phương trình phản ứng:
H3PO4 + 3NaOH → Na3PO4 + 3H2O
Từ ptpư suy ra:
nNaOH = 3nH3PO4 = 3. 0,025 = 0,075 (mol)
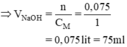
Đúng 0
Bình luận (0)
cho 19,6g kẽm tác dụng hết với dung dịch axit clohiddric.hãy cho biết:
a)thể tích khí H2 sinh ra (đktc)
b)nếu dùng thể tích H2 trên để khử hoàn toàn 19,2g sắt 3 oxit thì thu đc bao nhiêu g sắt
\(19,6\rightarrow19,5\\ n_{Zn}=\dfrac{19,5}{65}=0,3\left(mol\right)\)
PTHH: Zn + 2HCl ---> ZnCl2 + H2
0,3----------------------->0,3
=> VH2 = 0,3.22,4 = 6,72 (l)
\(n_{Fe_2O_3}=\dfrac{19,2}{160}=0,12\left(mol\right)\)
PTHH: Fe2O3 + 3H2 --to--> 2Fe + 3H2O
LTL: \(0,12>\dfrac{0,3}{3}\) => Fe2O3 dư
\(n_{Fe}=\dfrac{2}{3}.0,3=0,2\left(mol\right)\\ \rightarrow m_{Fe}=0,2.56=11,2\left(g\right)\)
Đúng 1
Bình luận (0)
\(n_{Zn}=\dfrac{19,6}{65}=0,3\left(mol\right)\\
pthh:Zn+2HCl\rightarrow ZnCl_2+H_2\)
0,3 0,6 0,3 0,3
\(V_{H_2}=0,3.22,4=6,72L\)
\(n_{Fe_2O_3}=\dfrac{19,2}{160}=0,12\left(mol\right)\\
pthh:Fe_2O_3+3H_2\rightarrow2Fe+3H_2O\)
\(ltl:\dfrac{0,12}{1}>\dfrac{0,3}{3}\)
= > Fe2O3 dư
\(n_{Fe}=n_{H_2}=0,3\left(mol\right)\\
m_{Fe}=0,3.56=16,8g\)
Đúng 0
Bình luận (0)
Để thu được muối photphat trung hòa, cần lấy bao nhiêu ml dung dịch NaOH 1M cho tác dụng với 50ml dung dịch H3PO4 0,5M?
$n_{H_3PO_4} = 0,05.0,5 = 0,025(mol)$
$3NaOH + H_3PO_4 \to Na_3PO_4 + 3H_2O$
Theo PTHH :
$n_{NaOH} = 3n_{H_3PO_4} = 0,075(mol)$
$V_{dd\ NaOH} = \dfrac{0,075}{1} = 0,075(lít) = 75(ml)$
Đúng 2
Bình luận (0)
Cần lấy bao nhiêu gam NaOH cho vào dung dịch H3PO4 để thu được dung dịch có chứa 2,84 gam Na2HPO4 và 6,56 gam Na3PO4
A. 4 gam
B. 6,4 gam
C. 7,68 gam
D. đáp án khác
Để thu được muối photphat trung hòa, cần lấy bao nhiêu ml dung dịch NaOH 1M cho tác dụng với 50 ml đe H3PO4 0,5M Giúp với ạ
Đúng 1
Bình luận (1)
\(n_{H_3PO_4}=0.05\cdot0.5=0.025\left(mol\right)\)
\(3NaOH+H_3PO_4\rightarrow Na_3PO_4+3H_2O\)
\(0.075......0.025\)
\(V_{dd_{NaOH}}=\dfrac{0.075}{1}=0.075\left(l\right)=75\left(ml\right)\)
Đúng 0
Bình luận (0)
Để thu được 28,4 g P2O5 cần dùng bo nhiêu g P và O2. Để lượng Oxi cho PƯ trên thì phải nung nóng bao nhiêu g KMnO4 biết hiệu suất 90%
\(n_{P_2O_5} = \dfrac{28,4}{142} = 0,2(mol)\)
4P + 5O2 \(\xrightarrow{t^o}\) 2P2O5
0,4...........0,5...............0,2.....................(mol)
Suy ra:
\(m_P = 0,4.31 = 12,4(gam)\\ m_{O_2} = 0,5.32 = 16(gam)\)
\(2KMnO_4 \xrightarrow{t^o} K_2MnO_4 + MnO_2 + O_2\\ n_{KMnO_4\ pư} = 2n_{O_2} = 1(mol)\\ \Rightarrow m_{KMnO_4\ đã\ dùng} = \dfrac{1.158}{90\%} = 175,5(gam)\)
Đúng 1
Bình luận (1)
Đốt cháy vật Al kim loại trong ko khí thu được nhôm oxit(Al2O3)
a. Viết PTHH đó
b. Nếu đốt cháy hết 4,05g bột Al thì thu được bao nhiêu g Al2O3?
c. Để thu đc 25,5g Al2O3 thì cần đốt cháy hết bao nhiêu g Al và dùng ít nhất bao nhiêu lít O2
Xem chi tiết
a) PTHH : 4 Al + 3\(O_2\) ---> \(2Al_2O_3\)
b)
\(n_{Al_2O_3}\) = \(\dfrac{m}{M}\) = 0.15 (mol)
Có : \(n_{Al}\) = \(\dfrac{1}{2}n_{Al_2O_3}\) = 0.15 . \(\dfrac{1}{2}\) = 0.075 (mol)
=> \(m_{Al_2O_3}\) = n.M = 7.65 (g)
c) \(n_{Al_2O_3}\) = \(\dfrac{m}{M}\) = 0.25 (mol)
Có : \(n_{Al_2O_3}=2n_{Al}\)
-> \(n_{Al}\) = 0.5 (mol)
=> \(m_{Al}\) = n.M = 13.5 (g)
Có : \(n_{Al_2O_3}=\dfrac{3}{2}n_{O_2}\) = 0.375 (mol)
=> \(V_{O_2\left(đktc\right)}\) = n.22.4 = 8.4 (L)
Đúng 1
Bình luận (0)
a. PTHH: 4Al + 3O2 ---> 2Al2O3
0,15 mol 0,1125 mol 0,075 mol
b. + Số mol của Al:
nAl = m/M = 4,05/27 = 0,15 (mol)
+ Khối lượng của Al2O3:
mAl2O3 = n.M = 0,075.102 = 7,65 (g)
Vậy: nếu đốt cháy hết 4,05 g bột Al thì thu được 7,65 g Al2O3
c. + Số g Al cần đốt:
mAl = n.M = 0,15.27 = 1,05 (g)
+ Số lít O2 cần đốt:
VO2 = n.22,4 = 0,1125.22,4 = 2,52 (l)
Vậy: để thu được 25,5 g Al2O3 thì cần đốt cháy hết 1,05 g Al và dùng ít nhất 2,52 lít O2
Note: mình không biết làm vậy đúng không nên trước khi tham khảo bạn hãy kiểm tra lại trước nhé, rồi có gì bảo mình.
Đúng 0
Bình luận (0)

























