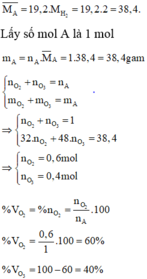Tại sao tỉ khối của O3 lớn hơn tỉ khối của O2 mà O3 lại nhẹ,nằm trên O2

Những câu hỏi liên quan
Tại sao tỉ khối của O3 lớn hơn tỉ khối của O2 mà O3 lại nhẹ,nằm trên O2
trong khí quyển có 1 cân bằng giữa O3 và O2 như sau:
O3 <---hv--> O2 + O
O3 nặng hơn O2 nên có xu hướng
xuống dưới, phía dưới là vùng của
bức xạ tử ngoại gần (2400-3600
angstron) nên phân hủy O3 thành
O2, cân bằng dịch chuyển sang phải,
do đó ở phía dưới tồn tại chủ yếu là
O2.
O2 nhẹ hơn có xu hướng bay lên cao,
tuy nhiên lên cao O2 hấp thu bức xạ
tử ngoại có bước sóng (1600-2400) lại
thành O3 như sau: O2 +hv---> 2O, O
+O2--> O3 do đó phía trên tồn tại
chủ yếu là O3
cân bằng O3 <--> O2 + O giữ cho
nồng độ O3 trên tầng cao của khí
quyển có nồng độ hầu như không đổi
Đúng 0
Bình luận (0)
Hỗn hợp T gồm O2 và O3 trong đó % khối lượng của O2 trong T bằng 50%. Tỉ khối của T so với He là:
Đặt mT = a (g)
\(\rightarrow\left\{{}\begin{matrix}m_{O_2}=50\%.a=0,5a\left(g\right)\\m_{O_3}=a-0,5a=0,5a\left(g\right)\end{matrix}\right.\\ \rightarrow\left\{{}\begin{matrix}n_{O_2}=\dfrac{0,5a}{32}=0,015625a\left(mol\right)\\n_{O_3}=\dfrac{0,5a}{48}=\dfrac{a}{96}\left(mol\right)\end{matrix}\right.\\ \rightarrow M_T=\dfrac{a}{0,015625a+\dfrac{a}{96}}=38,4\left(\dfrac{g}{mol}\right)\)
=> dT/He = \(\dfrac{38,4}{4}=9,6\)
Đúng 1
Bình luận (0)
Hỗn hợp khí A gồm có O2 và O3. Tỉ khối của hỗn hợp khí A đối với H2 là 19,2. Phần trăm theo thể tích của O2 và O3 trong hỗn hợp X lần lượt là A. 60% và 40%. B. 40% và 60%. C. 50% và 50%. D. 30% và 70%.
Đọc tiếp
Hỗn hợp khí A gồm có O2 và O3. Tỉ khối của hỗn hợp khí A đối với H2 là 19,2. Phần trăm theo thể tích của O2 và O3 trong hỗn hợp X lần lượt là
A. 60% và 40%.
B. 40% và 60%.
C. 50% và 50%.
D. 30% và 70%.
Cho hh X gồm O2 và O3. Sau một thời gian O3 phân hủy hết thu được khí duy nhất có thể tích tăng 5%. Tính tỉ khối của X với H2
\(Coi\ n_X = 1(mol) \Rightarrow n_{tăng} = 1.5\% =0,05(mol)\\ \Rightarrow n_{sau\ pư} = 1,05(mol)\\ Gọi\ n_{O_3} = a(mol)\\ 2O_3 \xrightarrow{} 3O_2 n_X = n_{O_2} + a = 1(mol)\\ n_{sau\ pư} = 1,5a + n_{O_2} = 1,05(mol)\\ \Rightarrow 1,5a - a = 1,05 - 1 \Rightarrow a = 0,1 \Rightarrow n_{O_2} = 1 - 0,1 = 0,9(mol)\\ M_X = \dfrac{0,1.48 + 0,9.32}{1} = 33,6(g/mol)\\ d_{X/H_2} = \dfrac{33,6}{2} = 16,8\)
Đúng 2
Bình luận (1)
O2: a mol
O3 : b mol
O3 ---------> 3/2 O2
b -> 1,5b
X: a+b
Y: a+1, 5b
Ta có: a+b/a+1,5b = 100/105
=> a = 9 b
Mx = (9b ×32 +b ×48) /( 9b+b) = 336b/10b = 33,6
dx/H2 = 33,6/2 = 16,8
Đúng 0
Bình luận (0)
Một hỗn hợp X gồm O2 và O3 có tỉ khối so với H2 là 18,4. Tính thể tích O3 cần thêm vào 10 lít hỗn hợp X để được hỗn hợp Y có tỉ khối so với H2 bằng 20
\(GS:n_{hh}=1\left(mol\right)\)
\(n_{O_2}=x\left(mol\right)\Rightarrow n_{O_3}=1-x\left(mol\right)\)
\(\overline{M}=32x+\left(1-x\right)\cdot48=36.8\left(\dfrac{g}{mol}\right)\)
\(\Rightarrow x=0.7\)
22.4 (l) có 0.7 mol O2 , 0.3 mol O3
10 (l) có 0.3125 mol O2 , 15/112 mol O3
\(\overline{M}=\dfrac{0.3125\cdot32+\left(\dfrac{15}{112}+a\right)\cdot48}{0.3125+\dfrac{15}{112}+a}=40\left(gmol\right)\)
\(\Rightarrow a=\dfrac{5}{28}\)
\(V_{O_3\left(ct\right)}=\dfrac{5}{28}\cdot22.4=4\left(l\right)\)
Chúc em học tốt !!
Đúng 3
Bình luận (18)
Cách khác: Ta dùng đường chéo hay tỉ lệ phần trăm đều được
Phương pháp 1: Dùng đường chéo
Áp dụng sơ đồ đường chéo ta có:
\(\dfrac{x}{10}=\dfrac{40-36,8}{48-40}=\dfrac{3,2}{8}\Rightarrow x=4\left(l\right)\)
Phương pháp 2: Dùng tỉ lệ phần trăm
Coi hỗn hợp X là 1 tạp khí của M là 36,8
Ta có: \(36,8.x+48.\left(1-x\%\right)=40\Rightarrow x=\dfrac{5}{7}\)
Hay \(\dfrac{V_{hh}}{V_{O_3}}=\dfrac{5}{2}\Rightarrow V_{O_3}=4\left(l\right)\)
Đúng 0
Bình luận (0)
GS:nhh=1(mol)GS:nhh=1(mol)
nO2=x(mol)⇒nO3=1−x(mol)nO2=x(mol)⇒nO3=1−x(mol)
¯¯¯¯¯¯M=0.3125⋅32+(15112+a)⋅480.3125+15112+a=40(gmol)M¯=0.3125⋅32+(15112+a)⋅480.3125+15112+a=40(gmol)
VO3(ct)=528⋅22.4=4(l)VO3(ct)=528⋅22.4=4(l)
Chúc em học tốt !!
Đọc tiếp
Đúng 0
Bình luận (0)
Hỗn hợp khí A gồm có O2 và O3,tỉ khối của hỗn hợp khí A đối với hiđro là 19,2. Hỗn hợp khí B gồm H2 và CO, tỉ khối của hỗn hợp khí B đối với hiđro là 3,6. Thành phần phần trăm theo thể tích của H2 và O2 lần lượt là? A. 80%, 60% B. 20%, 40% C. 80%, 60% D. 20%, 60%
Đọc tiếp
Hỗn hợp khí A gồm có O2 và O3,tỉ khối của hỗn hợp khí A đối với hiđro là 19,2. Hỗn hợp khí B gồm H2 và CO, tỉ khối của hỗn hợp khí B đối với hiđro là 3,6. Thành phần phần trăm theo thể tích của H2 và O2 lần lượt là?
A. 80%, 60%
B. 20%, 40%
C. 80%, 60%
D. 20%, 60%
hỗn hợp x gồm o2 và o3, 1 thời gian, O3 phân hủy thành O2, thể tích hỗn hợp tăng 4% so với ban đầu. Tính tỉ khối X so với H2
2o3=3o2
Số mol o2 là a
Số mol o3 là b mol nên no2 sinh ra là 1,5b mol
Số mol o2 sau phản ứng là 1,5b+a mol
số mol khí tăng 0,5b mol
0,5b=0,04(a+b)
11,5b=a
Dx/h2=(32a+48b) /(2a+2b) =16,64
Cậu tham khảo đi t không chắc
Đúng 0
Bình luận (0)
Hh O3 và O2 có tỉ khối so với H2 là 22.Thành phần % theo thể tích của oxi trong hh đầu tạo khí? Mình cần gấp ạ!!
Giả sử: \(\left\{{}\begin{matrix}n_{O_3}=x\left(mol\right)\\n_{O_2}=y\left(mol\right)\end{matrix}\right.\)
Vì: dhh/H2 = 22
\(\Rightarrow\dfrac{48x+32y}{x+y}=22.2\)
\(\Rightarrow x=3y\)
Ở cùng điều kiện nhiệt độ và áp suất, %n cũng là %V
\(\Rightarrow\left\{{}\begin{matrix}\%V_{O_3}=\dfrac{x}{x+y}.100\%=\dfrac{3y}{3y+y}.100\%=75\%\\\%V_{O_2}=25\%\end{matrix}\right.\)
Bạn tham khảo nhé!
Đúng 3
Bình luận (0)
Coi n hỗn hợp = 1(mol)
Gọi n O3 = a(mol) ; n O2 = b(mol)
Ta có :
a + b = 1
48a + 32b = 22.2 = 44
=> a = 0,75 ;b =0,25
Suy ra:
%V O3 = 0,75/1 .100% = 75%
%V O2 = 100% -75% = 25%
Đúng 1
Bình luận (0)
Gọi n hỗn hợp = $1(mol)$
=> $n O3 = a(mol) ; n O2 = b(mol)$
Ta có: $a + b = 1$
=> $48a + 32b = 22.2 = 44$
=> $a = 0,75 ; b =0,25$
<=> $%V O3 = 0,75/1 .100% = 75%$
Vậy $%V O2 = 100% -75% = 25%$
Đúng 0
Bình luận (0)
1) hỗn hợp A gồm O2 và O3 có tỉ khối hơi so với hiđro bằng 22 a) tính % thể tích mỗi khí trong hh b)tìm khối lượng mỗi khí có trong 2,24lít hh trên
Gọi a,b lần lượt là số mol của O2 và O3
=> \(\dfrac{32a+48b}{a+b}=22.2=44\)
\(\Leftrightarrow32a+48b=44a+44b\)
\(\Leftrightarrow12a=4b\)
=> b=3a
=> %VO2 = \(\dfrac{a}{a+3a}.100\%=25\%\), %VO3 = 75%
b) Thể tích O2 trong 2,24 lít khí là: 25%.2,24 = 0,56 lít
thể tích O3 = 1,68 lít
=> nO2 = \(\dfrac{0,56}{22,4}=0,025mol\Rightarrow mO_2=0,8g\)
\(nO_3=\dfrac{1,68}{22,4}=0,075mol\Rightarrow mO_3=0,075.48=3,6g\)
Đúng 2
Bình luận (0)