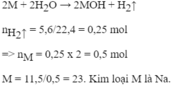Cho 0,3 ham một kim loại tác dụng hết với nước cho 168 ml khí hidro (đktc).Xác định tên kim loại

Những câu hỏi liên quan
cho 0,3 gam một kim loại tác dụng với hết với nước cho 168 ml chất khí hidro (ở dktc). xác định tên kim loại . biết kim loại có hóa trị tối đa là III
nH2=7,5.10-3 mol
M là kim loại
2M + 2nH2O --> 2M(OH)n + nH2
0,015n mol <------------ 7,5.10-3 mol
MM=0,3 / 0,015n = 20n
n=1 => M = 40
M là Canxi ( Ca )
Cho 11,5 gam một kim loại kiềm tác dụng hết với nước thu được 5,6 lít khí hidro (đktc). Xác định tên của kim loại (Li=7, Na=23, K=39, Ba=137).
Bài 1: Cho 5.52g một kim loại kiềm tác dụng với nước tạo ra 2.688 lít khí H2 (đktc). Xác định tên kim loại đó.
Bài 2: Cho 1.84g một kim loại kiềm tác dụng với nước tạo ra 896ml khí H2 (đktc). Xác định tên kim loại đó.
Bài 1:
Gọi kim loại kiềm là R
\(n_{H_2}=\dfrac{2,688}{22,4}=0,12\left(mol\right)\)
Giả sử R hóa trị I:
\(R+H_2O\rightarrow ROH+\dfrac{1}{2}H_2\\ \Rightarrow n_R=0,12.2=0,24\left(mol\right)\\ \Rightarrow M_R=\dfrac{5,52}{0,24}=23\left(đvC\right)\)
Giả sử đúng, tên kim loại đó là sodium (Na)
Bài 2: Tự làm tương tự bài 1 nhé=0
Đúng 2
Bình luận (0)
Cho 0,72 g một kim loại M tác dụng hết với dung dịch HCL dư thu được 672 ml khí H2 đktc . Xác định tên kim loại đó
\(n_{H_2}=\dfrac{0,672}{22,4}=0,03\left(mol\right)\)
PTHH: 2M + 2nHCl → 2MCln + nH2
Mol: \(\dfrac{0,06}{n}\) 0,03
\(M_M=\dfrac{0,72}{\dfrac{0,06}{n}}=12n\)
Do M là kim loại nên có hóa trị I,ll,lll
| n | l | ll | lll |
| MM | 12 | 24 | 36 |
| Kết luận | loại | thỏa mãn | loại |
⇒ M là magie (Mg)
Đúng 3
Bình luận (0)
1. Cho 0,6g một kim loại hóa trị II tác dụng với nước tạo ra 0,336 l khí H2(đktc). Tìm tên kim loại.
2. Cho 4.48g một oxit kim loại hóa trị II, tác dụng hết với 100ml dung dịch H2SO4 0,8M. Xác định tên kim loại.
*trình bày chi tiết giúp mình với ạ
\(n_{H_2}=\dfrac{0.336}{22.4}=0.015\left(mol\right)\)
\(M+2HCl\rightarrow MCl_2+H_2\)
\(0.015........................0.015\)
\(M_M=\dfrac{0.6}{0.015}=40\left(\dfrac{g}{mol}\right)\)
\(M:Canxi\left(Ca\right)\)
Đúng 4
Bình luận (1)
\(n_{H_2SO_4}=0.1\cdot0.8=0.08\left(mol\right)\)
\(M+H_2SO_4\rightarrow MSO_4+H_2\)
\(0.08.....0.08\)
\(M_M=\dfrac{4.48}{0.08}=56\left(\dfrac{g}{mol}\right)\)
\(M:Sắt\left(Fe\right)\)
Đúng 3
Bình luận (1)
1/
nH2=0,336/22,4=0,015(mol)
gọi KL là M.
PTHH:M+2H2O-->M(OH)2+H2(1)
0,015 0,015 (mol)
Từ pt(1)-->nM=0,015(mol)
-->MM=0,6/0,015=40(g/mol)
-->M là Canxi(Ca)
2/
nH2SO4=0,1.0,8=0,08(mol)
gọi KL là R
PTHH:R+H2SO4-->RSO4+H2(2)
0,08 0,08 (mol)
từ pt (2)-->nR=0,08(mol)
-->MR=4,48/0,08=56(g/mol)
-->R là Sắt(Fe)
nhớ tích đúng cho mình nha!
Đúng 12
Bình luận (1)
8/ Cho 0,7g kim loại A vào dd axit H2SO4loãng, dư. Sau khi phản ứng xảy ra hoàn toànthu được 0,28 lit khí hidro(đktc). Hãy xác định tên kim loại A9/ Cho 0,3 g một nguyên tố Kloai t/d hết với nước cho 168ml khí H2 (dktc) Xđ ng tố kim loại.Biết rằng KL có hoá trị tối đa là III.10/ Cho dòng khí CO(dư) qua hỗn hợp hai oxit Fe3O4 và CuO nung nóng.thu đuợc 29,6 g hỗn hợp hai kloại trong đó Fe có nhiều hơn Cu là 4g . Tính thể tích khí CO cần dùng
Đọc tiếp
8/ Cho 0,7g kim loại A vào dd axit H2SO4loãng, dư. Sau khi phản ứng xảy ra hoàn toàn
thu được 0,28 lit khí hidro(đktc). Hãy xác định tên kim loại A
9/ Cho 0,3 g một nguyên tố Kloai t/d hết với nước cho 168ml khí H2 (dktc) Xđ ng tố kim loại.Biết rằng KL có hoá trị tối đa là III.
10/ Cho dòng khí CO(dư) qua hỗn hợp hai oxit Fe3O4 và CuO nung nóng.thu đuợc 29,6 g hỗn hợp hai kloại trong đó Fe có nhiều hơn Cu là 4g . Tính thể tích khí CO cần dùng
10
PTHH: Fe3O4+4Co->3Fe+4Co2 (1)
CuO+Co->Cu+Co2 (2)
Lại có: mFe+mCu=29,6
mFe-mCu=4
=>mFe=16,8=> nFe=0.3mol
mCu=12,8g=>nCu=0.2mol
Theo PTHH(1)
nFe:nCo= 3:4=> nCo=0,3.4/3=0,4mol
nCu:nCo= 1:1 => nCo= 0,2mol
=> nCo=0,6mol=13,44(l)
9
Gọi là kí hiệu, nguyên tử khối của kim loại , có hóa trị n
Phương trình hóa học của phản ứng:
2R+2nH2O→2R(OH)n+nH2
2R g n mol
0,3 g \(\dfrac{168}{22400}\)=0,0075mol
Theo phương trình hóa học trên, ta có
\(\dfrac{2R}{3}=\dfrac{n}{0,0075}\)=n\0,0075
2R x 0,0075=0,3n —-> R=20n
Với: n=1 —> R=20 khoong có kim loại nào có nguyên tử khối là 20 (loại)
n=2 —->R=40 (Ca)
n=3 —–> R= 60 (loại)
Kim loại là Ca
Đúng 3
Bình luận (0)
a)Cho 0,72 g một kim loại M tác dụng hết với dung dịch HCL dư thu được 672 ml khí H2 đktc . Xác định tên kim loại đó
b)nếu dùng 200 ml dung dịch axit HCL 0,5 ml cho phản ứng trên Tính CM chất tan trong dung dịch A
\(a,\) Đặt hóa trị của M là \(x(x>0)\)
\(n_{H_2}=\dfrac{0,672}{22,4}=0,03(mol)\\ PTHH:2M+2xHCl\to 2MCl_x+xH_2\\ \Rightarrow n_{M}=\dfrac{0,03}{x}.2=\dfrac{0,06}{x}(mol)\\ \Rightarrow M_M=\dfrac{0,72}{\dfrac{0,06}{x}}=12x\)
Thay \(x=2\Rightarrow M_M=24(g/mol)\)
Vậy M là magie (Mg)
\(b,n_{HCl}=0,5.0,2=0,1(mol)\)
Vì \(\dfrac{n_{HCl}}{2}>\dfrac{n_{H_2}}{1}\) nên \(HCl\) dư
\(\Rightarrow n_{MgCl_2}=n_{H_2}=0,03(mol)\\ \Rightarrow C_{M_{MgCl_2}}=\dfrac{0,03}{0,2}=0,15M\)
Đúng 2
Bình luận (0)
Cho 7,02 gam kim loại kiềm tác dụng hết với nước thu được 0,18 gam khí ( đktc). Xác định tên kim loại là ( Na=23, K=39, Ba=137, Ca=40)
Gọi CTHH của kim loại kiềm là A
A + H2O ----> AOH + 1/2H2
nH2 = 0,18/2 = 0,09 (mol)
Theo pthh : nA = 2nH2 = 0,18 (mol)
=> MA = mA/nA = 7,02/0,18 = 39 (g/mol)
=> Kim loại cần tìm là Kali
Đúng 1
Bình luận (0)
Khi cho 0,9 gam một kim loại nhóm IIA tác dụng với nước tạo ra 0,504 lít khí hiđro (ở đktc) . Xác định tên kim loại đó?
Gọi kim loại cần tìm là R.
\(n_{H_2}=\dfrac{0,504}{22,4}=0,0225mol\)
\(R+H_2O\rightarrow RO+H_2\)
0,0225 0,0225
Mà \(n_R=\dfrac{m_R}{M_R}=\dfrac{0,9}{M_R}=0,0225\Rightarrow M_R=40\left(đvC\right)\)
Vậy R là nguyên tố canxi.
KHHH: Ca
Đúng 0
Bình luận (0)