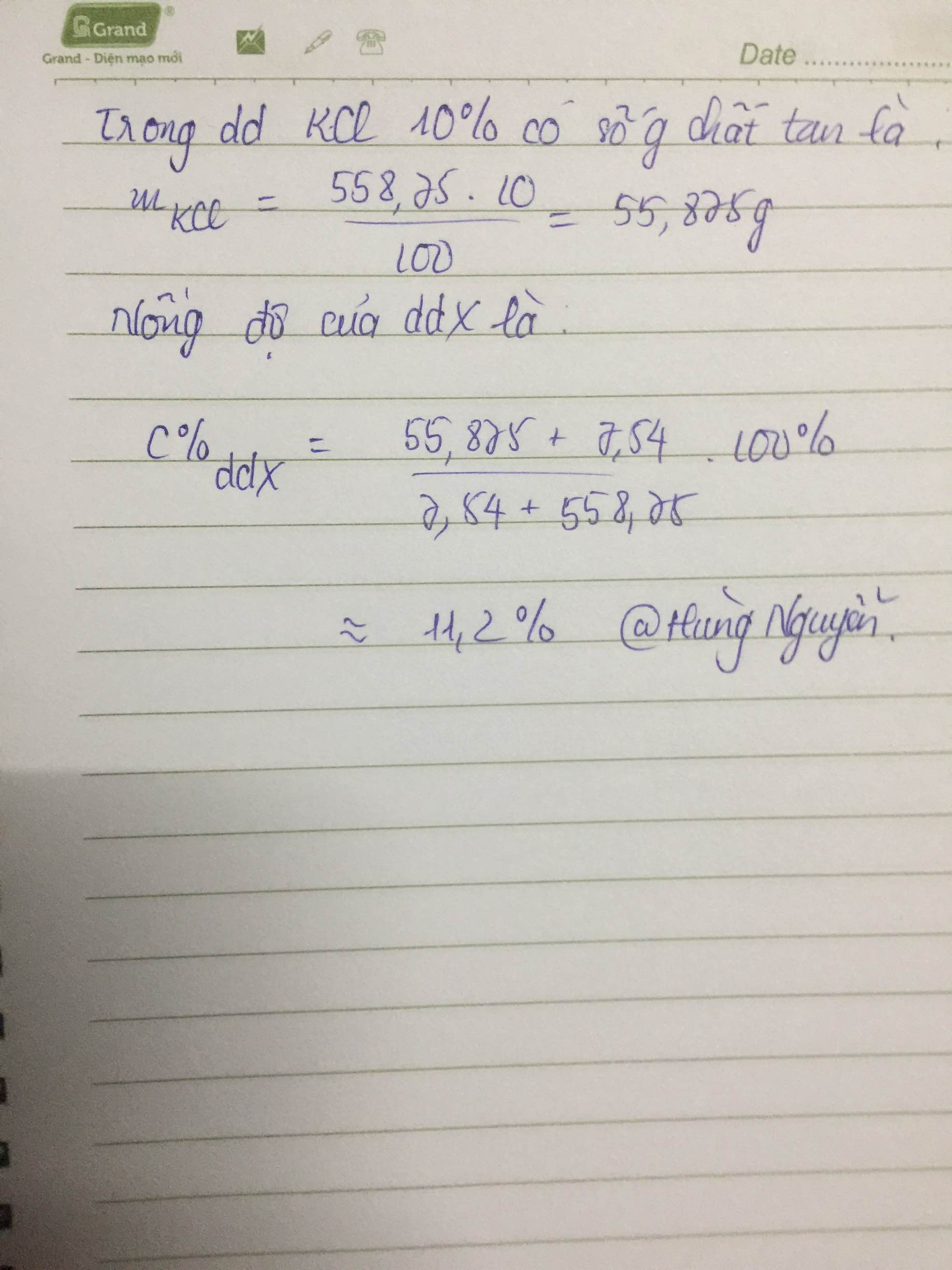Hòa tan hoàn toàn 5,475g CaCl2.6H2O vào 100 ml dd X. Tính nồng độ mol của dd X

Những câu hỏi liên quan
Hòa tan hoàn toàn 5,475g CaCl2.6H2O vào 100ml dd X. Tính nồng độ % của dd X
\(n_{CaCl_2.6H_2O}=n_{CaCl_2}=\dfrac{5,475}{219}=0,025\left(mol\right)\)
Ta có :100ml H2O ~ 100g H2O
=> \(C\%_{CaCl_2}=\dfrac{0,025.111}{100+5,4750}.100=2,63\%\)
Đúng 2
Bình luận (0)
Hòa tan hoàn toàn 4,55g kim loại Zn vào 200 mL dd HCl (khối lượng riêng là 0,8 g/ml), sau PƯ thu đc V lít khí (đktc) và dd X
a) Tính nồng độ mol dd HCl tham gia PƯ
b) Tính giá trị V
c) Cô cạn dd X hoàn toàn, tính khối lượng chất rắn còn lại
d) Cho dd X PƯ đủ với 200g dd AgNO3, thu đc ddY. Tính nồng độ % dd Y
(Cho Zn=65, Cl=35.5, H=1)
\(n_{Zn}=\dfrac{4,55}{65}=0,07(mol)\\ Zn+2HCl\to ZnCl_2+H_2\\ a,n_{HCl}=0,14(mol)\\ \Rightarrow C_{M_{HCl}}=\dfrac{0,14}{0,2}=0,7M\\ b,n_{H_2}=0,07(mol)\\ \Rightarrow V_{H_2}=0,07.22,4=1,568(l)\\ c,n_{ZnCl_2}=0,07(mol)\\ \Rightarrow m_{ZnCl_2}=0,07.136=9,52(g)\\ c,ZnCl_2+2AgNO_3\to 2AgCl\downarrow+Zn(NO_3)_2\)
\(m_{dd_{ZnCl_2}}=200.0,8+4,55-0,07.2=164,41(g)\\ n_{AgCl}=0,14(mol);n_{Zn(NO_3)_2}=0,07(mol)\\ \Rightarrow C\%_{Zn(NO_3)_2}=\dfrac{0,07.189}{164,41+200-0,14.143,5}.100\%=3,84%\)
Đúng 3
Bình luận (0)
Hòa tan hoàn toàn 28,6 g Na2CO3.10H2O vào đủ để tạo thành 200 ml dd. Xác định nồng độ % và nồng độ mol của dd. Biết dd này có KLR D = 1,05g/ml
$n_{Na_2CO_3} = n_{Na_2CO_3.10H_2O} = \dfrac{28,6}{286} = 0,1(mol)$
$C_{M_{Na_2CO_3}} = \dfrac{0,1}{0,2} = 0,5M$
$m_{dd} = D.V = 200.1,05 = 210(gam)$
$C\%_{Na_2CO_3} = \dfrac{0,1.106}{210}.100\% = 5,05\%$
Đúng 3
Bình luận (0)
\(m_{dd}\)=1,05.200=210 g
=>C%dd =\(\dfrac{28,6}{210}\) .100% =13,62%
Mặt khác : 200ml=0,2l
Mct=23.2+12+16.3+10.(1.2+16)=286 (M nguyên tử khối )
=>nct=\(\dfrac{28,6}{286}\) =0,1 mol
=>CM=\(\dfrac{0,1}{0,2}\) =0,5M
Đúng 1
Bình luận (0)
Hòa tan hoàn toàn 1,2g MgO vào 300 ml dd H2SO4
a. Tính nồng độ mol của axit đã dùng
b. Tính khối lượng muối tạo thành.
Hòa tan 12,75g NaOH3 vào nước thu được 300 ml dd X. Tính nồng độ mol của dd X
\(n_{NaOH}=\dfrac{12.75}{40}=\dfrac{51}{160}\left(mol\right)\)
\(C_{M_{NaOH}}=\dfrac{\dfrac{51}{160}}{0.3}=1.0625\left(M\right)\)
Đúng 3
Bình luận (0)
Hòa tan hoàn toàn 2, 5 gam hh X gồm hai kim 1oại kiềm thổ vào 200 ml dd HCl 1,25M thu được dd Y chứa các chất tan có nồng độ mol bằng nhau. Hai kim loại trong X 1à
A. Mg và Ca.
B. Be và Mg.
C. Mg và Sr.
D. Be và Ca.
Đáp án D

TH1: HCl hết
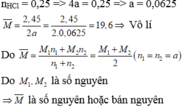
TH2: HCl dư: a mol
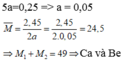
Đúng 0
Bình luận (0)
Hòa tan hoàn toàn 7,45g KCl vào 558,75g dd KCl 10% thu được dd X. Tính nồng độ % của dd X
hòa tan hoàn toàn 14g fe trong 100ml HCl a M vừa đủ thu được dd X vừa đủ và V lít khí H2 (đkc).
a, xd giá trih của V và a.
b, cho 400 ml đ vào AgNO3 1.3M vào dd X thu được m gam chất rắn và dd Y. tính m và nồng độ mol các chất có trong dd Y
GIÚP EM VỚI ẠAAAAAA
a, \(Fe+2HCl\rightarrow FeCl_2+H_2\)
Ta có: \(n_{Fe}=\dfrac{14}{56}=0,25\left(mol\right)\)
Theo PT: \(\left\{{}\begin{matrix}n_{HCl}=2n_{Fe}=0,5\left(mol\right)\\n_{H_2}=n_{Fe}=0,25\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow V_{H_2}=0,25.24,79=6,1975\left(l\right)\)
\(a=C_{M_{HCl}}=\dfrac{0,5}{0,1}=5\left(M\right)\)
b, Theo PT: \(n_{FeCl_2}=n_{Fe}=0,25\left(mol\right)\)
Ta có: \(n_{AgNO_3}=0,4.1,3=0,52\left(mol\right)\)
PT: \(2AgNO_3+FeCl_2\rightarrow Fe\left(NO_3\right)_2+2AgCl_{\downarrow}\)
______0,5______0,25______0,25________0,5 (mol)
\(AgNO_3+Fe\left(NO_3\right)_2\rightarrow Fe\left(NO_3\right)_3+Ag_{\downarrow}\)
0,02______0,02________0,02________0,02 (mol)
⇒ m = mAgCl + mAg = 0,5.143,5 + 0,02.108 = 73,91 (g)
- Dd sau pư gồm: Fe(NO3)3: 0,02 (mol) và Fe(NO3)2: 0,25 - 0,02 = 0,23 (mol)
\(\Rightarrow\left\{{}\begin{matrix}C_{M_{Fe\left(NO_3\right)_3}}=\dfrac{0,02}{0,1+0,4}=0,04\left(M\right)\\C_{M_{Fe\left(NO_3\right)_2}}=\dfrac{0,23}{0,1+0,4}=0,46\left(M\right)\end{matrix}\right.\)
Đúng 1
Bình luận (0)
\(Fe+2HCl->FeCl_2+H_2\\ a.V=\dfrac{14}{56}\cdot22,4=5,6\left(L\right)\\ a=\dfrac{\dfrac{14}{56}\cdot2}{0,1}=5\left(M\right)\\ b.n_{AgNO_3}=0,4\cdot1,3=0,52mol\\ FeCl_2+AgNO_3->Fe\left(NO_3\right)_2+AgCl\\ Fe\left(NO_3\right)_2+AgNO_3->Ag+Fe\left(NO_3\right)_3\\ m=0,25\cdot143,5+0,25\cdot108=62,875\left(g\right)\\ C_{M\left(AgNO_3\right)}=\dfrac{0,02}{0,5}=0,04M\\ C_{M\left(Fe\left(NO_3\right)_3\right)}=\dfrac{0,25}{0,5}=0,5M\)
Đúng 0
Bình luận (0)
Hòa tan hoàn toàn 1,2g MgO vào 300 ml dd H2SO4
Tính nồng độ mol của axit đã dùng
Tính khối lượng muối tạo thành.
a. Ta có: \(n_{MgO}=\dfrac{1,2}{40}=0,03\left(mol\right)\)
PTHH: \(MgO+H_2SO_4--->MgSO_4+H_2O\)
Theo PT: \(n_{H_2SO_4}=n_{MgO}=0,03\left(mol\right)\)
Đổi 300ml = 0,3 lít
=> \(C_{M_{H_2SO_4}}=\dfrac{0,03}{0,3}=0,1M\)
b. Theo PT: \(n_{MgSO_4}=n_{MgO}=0,03\left(mol\right)\)
=> \(m_{MgSO_4}=0,03.120=3,6\left(g\right)\)
Đúng 1
Bình luận (0)