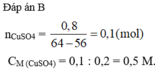Kim loại tác dụng với dung dịch muối
Chuẩn bị:
+ Hoá chất: đinh sắt mới (đã rửa sạch lớp dầu mỡ), dung dịch CuSO4 1 M.
+ Dụng cụ: cốc thuỷ tinh, kẹp sắt.
Tiến hành: Cho đinh sắt vào cốc. Thêm tiếp 2 - 3 mL dung dịch CuSO4 1M. Sau 5 phút dùng kẹp lấy đinh sắt ra khỏi dung dịch.
Thực hiện yêu cầu sau: Mô tả hiện tượng xảy ra, giải thích và viết phương trình hoá học.