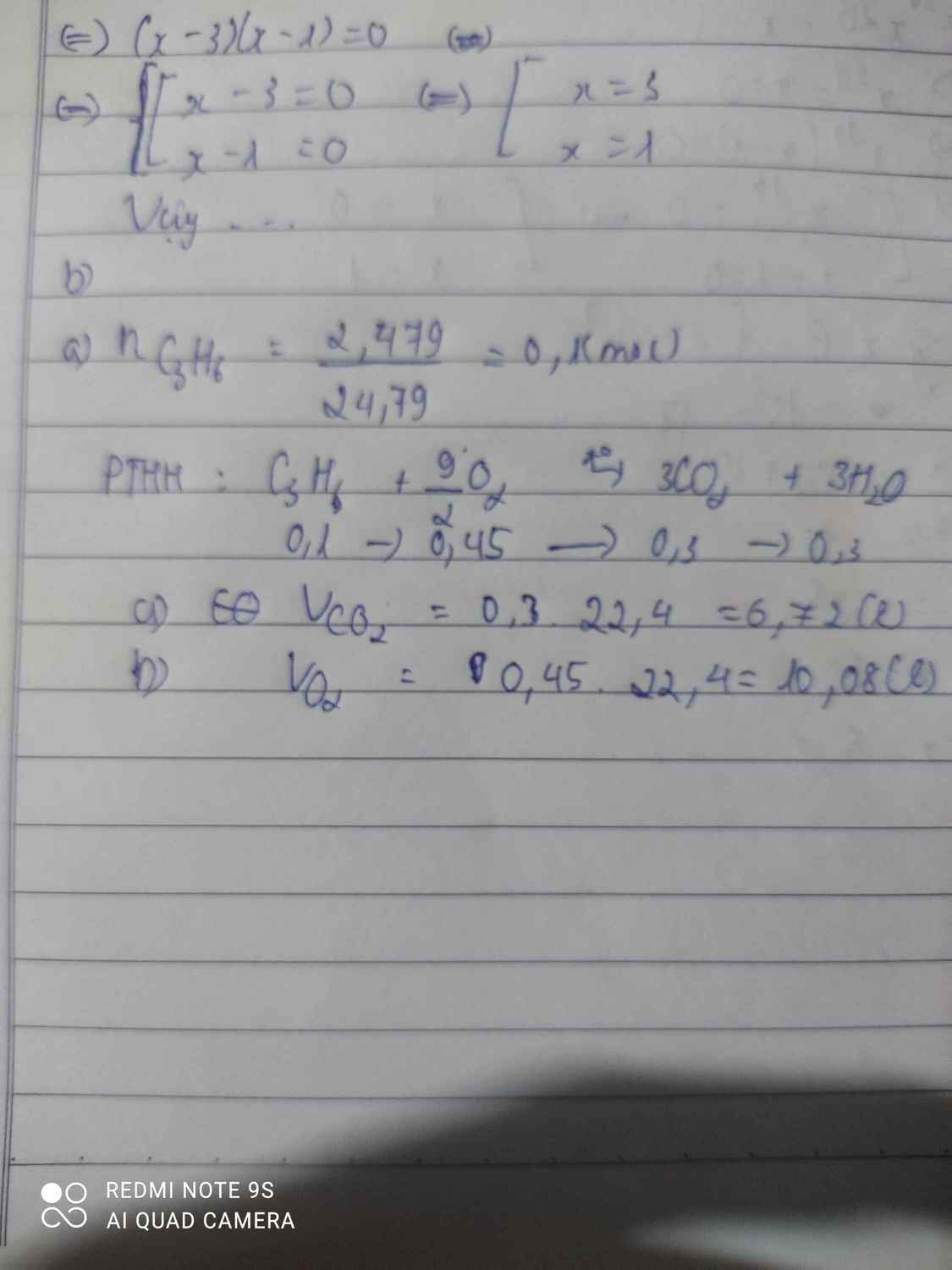Đốt cháy 3.72g phosphorous trong khí oxygen tính thể tích oxygen cần dùng

Những câu hỏi liên quan
Đốt cháy hoàn toàn 6,2 gam phosphorous trong bình đựng khí oxygen. Hãy: a. Tính khối lượng sản phẩm thu được. b. Tính thể tích khí oxygen (đkc) cần dùng. Biết P=31; O=16
4P+5O2-to>2P2O5
0,2-----0,25----0,1
n P=\(\dfrac{6,2}{31}\)=0,2 mol
=>VO2=0,25.24,79=6,1975l
=>m P2O5=0,1.142=14,2g
Đúng 2
Bình luận (0)
bài 1: đốt cháy hoàn toàn 4,05 gam nhôm (aluminium) trong oxi(oxygen) dư.a. tính thể tích khí oxi (oxygen) cần dùng ở đktcb. tính khối lượng oxit thu đcbài 2: đốt cháy hoàn toàn 8,4 gam sắt (iron) trong không khía. tính thể tích không khí cần dùng ở đktc. biết oxi chỉ chiếm 20% thể tích không khíb.tính khối lượng oxit thu đcbài 3: nhiệt phân hoàn toàn KClO3a. tính thể tích khí thu đc ở đktcb. tính khối lượng muối thu đượcbài 4:hoàn thành các phản ứng sau và phân loại các phản ứng đã viết:a. nhiệ...
Đọc tiếp
bài 1: đốt cháy hoàn toàn 4,05 gam nhôm (aluminium) trong oxi(oxygen) dư.
a. tính thể tích khí oxi (oxygen) cần dùng ở đktc
b. tính khối lượng oxit thu đc
bài 2: đốt cháy hoàn toàn 8,4 gam sắt (iron) trong không khí
a. tính thể tích không khí cần dùng ở đktc. biết oxi chỉ chiếm 20% thể tích không khí
b.tính khối lượng oxit thu đc
bài 3: nhiệt phân hoàn toàn KClO3
a. tính thể tích khí thu đc ở đktc
b. tính khối lượng muối thu được
bài 4:hoàn thành các phản ứng sau và phân loại các phản ứng đã viết:
a. nhiệt phân KClO3
b. nhiệt phân KMnO4
c. Fe+O2
d.CH4+02
e.Al+O2
f.Mg+O2
g.C+O2
h.P+O2
đốt cháy 2,479 lít propane trong khí oxygen (đkc) thì thu được khí carbonic và hơi nước
a. Tính thể tích khí CO2 thu được.
b. Tính thể tích khí oxygen cần dùng.
n C3H8=0,1 mol
C3H8+5O2-to>3CO2+4H2O
0,1-----0,5------------0,3-----0,4 mol
=>VCO2=0,3.22,4=6,72 l
=>VO2=0,5.22,4=11,2l
Đúng 3
Bình luận (0)
4. Carbon cháy trong khí oxygen hoặc trong không khí sinh ra khí carbon dioxxide: C + O2 → CO2 Hãy tính thể tích khí oxygen O2 (đktc) cần dùng để đốt cháy hoàn toàn 24 gam carbon C
Đốt cháy 5.4g Aluminium trong khí oxygen tính thể tích oxygen cần dùng ( 25°C , 1bar)
Biết phản ứng xảy ra theo sơ đồ Al+O2 -- --> Al2O3
\(m_{Al}=\dfrac{5,4}{27}=0,2\left(mol\right)\)
PT: \(4Al+3O_2\underrightarrow{t^o}2Al_2O_3\)
Theo PT: \(n_{O_2}=\dfrac{3}{4}n_{Al}=0,15\left(mol\right)\Rightarrow V_{O_2}=0,15.24,79=3,7185\left(l\right)\)
Đúng 2
Bình luận (0)
Đốt cháy 0,62g phosphourus với oxygen. Tính thể tích khí oxygen cần dùng ở đkc? Tính khối lượng sản phẩm P205 thu được?
\(n_P=\dfrac{0,62}{31}=0,02\left(mol\right)\\ 4P+5O_2\rightarrow\left(t^o\right)2P_2O_5\\ n_{P_2O_5}=\dfrac{2}{4}.0,02=0,01\left(mol\right);n_{O_2}=\dfrac{5}{4}.0,02=0,025\left(mol\right)\\ V_{O_2\left(đkc\right)}=0,025.24,79=0,61975\left(l\right)\\ m_{P_2O_5}=142.0,01=1,42\left(g\right)\)
Đúng 6
Bình luận (0)
\(n_P=\dfrac{m}{M}=\dfrac{0,62}{31}=0,02mol\)
PTHH: \(4P+5O_2\underrightarrow{t^o}2P_2O_5\)
4 5 2 ( mol )
0,02 0,025 0,01 ( mol )
\(V_{O_2}=n_{O_2}.22,4=0,025.22,4=0,56l\)
\(m_{P_2O_5}=n_{P_2O_5}.M_{P_2O_5}=0,01.142=1,42g\)
Đúng 2
Bình luận (0)
1) Đốt cháy hoàn toàn iron trong khí oxygen thu được 2,32 gam iron (II, III) oxide (Fe3 O4). Tính khối lượng iron cần dùng
2) Tính khối lượng CuO thu được khi đốt cháy 3,2 gam Cu
3) Tính thể tích khí oxygen (đkc) cần dùng để dốt cháy 4,6 gam sodium
4) Tính thể tích khí oxygen (đkc) cần dùng để đốt cháy 1,6 gam Cu
1.\(n_{Fe_3O_4}=\dfrac{2,32}{232}=0,01mol\)
\(3Fe+2O_2\rightarrow\left(t^o\right)Fe_3O_4\)
0,3 0,1 ( mol )
\(m_{Fe}=0,3.56=16,8g\)
2.\(n_{Cu}=\dfrac{3,2}{64}=0,05mol\)
\(2Cu+O_2\rightarrow\left(t^o\right)2CuO\)
0,05 0,05 ( mol )
\(m_{CuO}=0,05.80=4g\)
3.\(n_{Na}=\dfrac{4,6}{23}=0,2mol\)
\(4Na+O_2\rightarrow\left(t^o\right)2Na_2O\)
0,2 0,05 ( mol )
\(V_{O_2}=0,05.24,79=1,2395l\)
4.\(n_{Cu}=\dfrac{1,6}{64}=0,025mol\)
\(2Cu+O_2\rightarrow\left(t^o\right)2CuO\)
0,025 0,0125 ( mol )
\(V_{O_2}=0,0125.24,79=0,309875l\)
Đúng 1
Bình luận (0)
BÀI 2: Đốt cháy hoàn toàn 4,8 gam Mg trong khí oxygen (O2) thu được MgO.a. Viết phương trình hóa học.b. Tính thể tích khí O2 cần dùng ở đktc (25oC, 1 bar).c. Tính khối lượng MgO thu đượcBÀI 3: Đốt cháy hoàn toàn 2,4 gam Mg trong 1,6 gam khí oxygen (O2) thu được MgO.a. Viết công thức về khối lượng của phản ứng xảy ra.b. Tính khối lượng MgO thu được.c. Khối lượng khí O2 tham gia ở trên tương đương bao nhiêu phân tử?Cho: Mg 24; O 16; H 1
Đọc tiếp
BÀI 2: Đốt cháy hoàn toàn 4,8 gam Mg trong khí oxygen (O2) thu được MgO.
a. Viết phương trình hóa học.
b. Tính thể tích khí O2 cần dùng ở đktc (25oC, 1 bar).
c. Tính khối lượng MgO thu được
BÀI 3: Đốt cháy hoàn toàn 2,4 gam Mg trong 1,6 gam khí oxygen (O2) thu được MgO.
a. Viết công thức về khối lượng của phản ứng xảy ra.
b. Tính khối lượng MgO thu được.
c. Khối lượng khí O2 tham gia ở trên tương đương bao nhiêu phân tử?
Cho: Mg = 24; O = 16; H = 1
Bài 2:
a) 2Mg + O2 --to--> 2MgO
b) \(n_{Mg}=\dfrac{4,8}{24}=0,2\left(mol\right)\)
PTHH: 2Mg + O2 --to--> 2MgO
_______0,2->0,1------>0,2
=> VO2 = \(\dfrac{0,1.0,082.\left(273+25\right)}{0,99}=2,468\left(l\right)\)
c) mMgO = 0,2.40 = 8(g)
Bài 3
a) Theo ĐLBTKL: mMg + mO2 = mMgO (1)
b) (1) => mMgO = 2,4 + 1,6 = 4(g)
c) \(nO_2=\dfrac{1,6}{32}=0,05\left(mol\right)\)
=> Số phân tử O2 = 0,05.6.1023 = 0,3.1023
Đúng 4
Bình luận (0)
Đốt cháy Aluminium trong không khí thu được 30,6 gam Aluminium Oxide.
a) Viết PTHH
b) Tính khối lượng Aluminium bị đốt cháy
c) Tính thể tích khí Oxygen cần dùng (đkc) (Al=27,O=16)
\(a,PTHH:4Al+3O_2\rightarrow\left(t^o\right)2Al_2O_3\\ b,n_{Al_2O_3}=\dfrac{30,6}{102}=0,3\left(mol\right)\\ n_{Al}=\dfrac{4}{2}.n_{Al_2O_3}=2.0,3=0,6\left(mol\right)\\ \Rightarrow m_{Al}=0,6.27=16,2\left(g\right)\\ c,n_{O_2}=\dfrac{3}{2}.n_{Al_2O_3}=\dfrac{3}{2}.0,3=0,45\left(mol\right)\\ \Rightarrow V_{O_2\left(đkc\right)}=0,45.24,79=11,1555\left(l\right)\)
Đúng 2
Bình luận (2)
a, \(4Al+3O_2\underrightarrow{t^o}2Al_2O_3\)
b, \(nAl_2O_3=\dfrac{30,6}{102}=0,3\left(mol\right)\)
\(nAl=\dfrac{4}{2}.0,3=0,6\left(mol\right)\)
\(mAl=0,6.27=16,2\left(g\right)\)
c, \(nO_2=\dfrac{3}{2}.0,3=0,45\left(mol\right)\)
\(VO_{2\left(đkc\right)}=0,45.24,79=11,1555\left(l\right)\)
Đúng 0
Bình luận (2)
a) PTHH: \(4Al+3O_2\rightarrow^{t^0}2Al_2O_3\).
b) \(n_{Al_2O_3}=\dfrac{m}{M}=\dfrac{30,6}{102}=0,3\left(mol\right)\)
-Theo PTHH trên, ta có:
\(n_{Al}=\dfrac{n_{Al_2O_3}}{2}.4=\dfrac{0,3}{2}.4=0,6\left(mol\right)\)
\(\Rightarrow m_{Al}=0,6.27=16,2\left(mol\right)\)
c) -Theo PTHH trên, ta có:
\(n_{O_2}=\dfrac{n_{Al_2O_3}}{2}.3=\dfrac{0,3}{2}.3=0,45\left(mol\right)\).
\(\Rightarrow V_{O_2\left(đktc\right)}=n.24,79=0,45.24,79=11,1555\left(l\right)\)
Đúng 2
Bình luận (1)