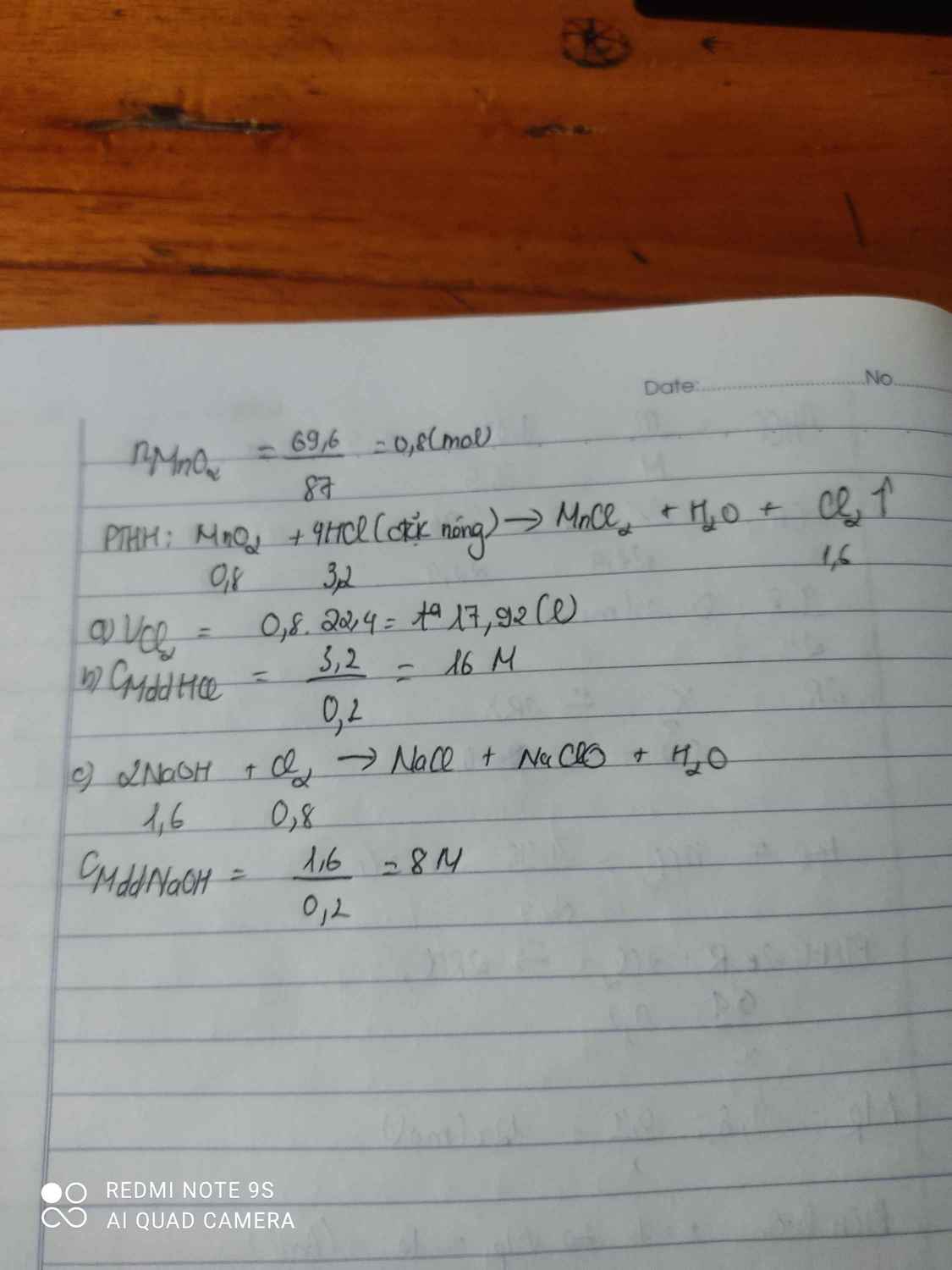cho 2,6 g kẽm vào dung dịch HCL 0,5 mol ta thu được vào dung dịch muối và khí hidro
a. Tính thể tích dung dịch HCL cần dùng b. tính thể tích khí H2 ở điều kiện tiêu chuẩn
Những câu hỏi liên quan
Cho 5,6g sắt tác dụng với 100ml dung dịch axit clohidric HCl thu được sắt 2 và khí hidro thoát ra ở điều kiện tiêu chuẩn a,tính thể tích khí hidro thoát ra ở điều kiện tiêu chuẩn b,tính nồng độ mol của dung dịch axit clohidric đã dùng Giúp với ạ sắp thi r
`Fe + 2HCl -> FeCl_2 + H_2 \uparrow`
`0,1` `0,2` `0,1` `0,1` `(mol)`
`n_[Fe]=[5,6]/56=0,1(mol)`
`a)V_[H_2]=0,1.22,4=2,24(l)`
`b)C_[M_[HCl]]=[0,2]/[0,1]=2(M)`
Đúng 3
Bình luận (2)
Hòa tan hoàn toàn 13g Zn vào 200 gam dung dịch H2SO4 thu được dung dịch chứa muối Kẽm Clorua và khí Hidro thoát raa/Tính thể tích H2 sinh ra ở điều kiện tiêu chuẩn?b/Tính nồng độ phần trăm của dung dịch muối thu được?c/Tính khối lượng chất rắn thu được khi dẫn toàn bộ khí H2 thu được ở trên đi qua 24 gam CuO nung nóng?( Cho: O16; H1; Zn65; Cl35,5; Cu64)
Đọc tiếp
Hòa tan hoàn toàn 13g Zn vào 200 gam dung dịch H2SO4 thu được dung dịch chứa muối Kẽm Clorua và khí Hidro thoát ra
a/Tính thể tích H2 sinh ra ở điều kiện tiêu chuẩn?
b/Tính nồng độ phần trăm của dung dịch muối thu được?
c/Tính khối lượng chất rắn thu được khi dẫn toàn bộ khí H2 thu được ở trên đi qua 24 gam CuO nung nóng?
( Cho: O=16; H=1; Zn=65; Cl=35,5; Cu=64)
\(n_{Zn}=\dfrac{13}{65}=0,2mol\)
\(Zn+H_2SO_4\rightarrow ZnSO_4+H_2\)
0,2 0,2 0,2 0,2
a)\(V_{H_2}=0,2\cdot22,4=4,48l\)
b)\(m_{ZnSO_4}=0,2\cdot161=32,2g\)
\(m_{ddZnSO_4}=30+200-0,2\cdot2=229,6g\)
\(C\%=\dfrac{m_{ct}}{m_{dd}}\cdot100\%=\dfrac{32,2}{229,6}\cdot100\%=14,02\%\)
c)\(n_{CuO}=\dfrac{24}{80}=0,3mol\)
\(CuO+H_2\rightarrow Cu+H_2O\)
0,3 0,2 0,2
\(m_{rắn}=m_{Cu}=0,2\cdot64=12,8g\)
Đúng 3
Bình luận (0)
C%=mctmdd⋅100%=19,6200⋅100%=9,8%C%=mctmdd⋅100%=19,6200⋅100%=9,8%
c)
Đúng 0
Bình luận (0)
bn mik hỏi tí aj
đoạn mdd ZnSO4 ấy, 30 ở đâu ra v ạ
Đúng 0
Bình luận (0)
Hòa tan hoàn toàn 3,9 gam Zn vào dung dịch HCl 14,6 % a. Tính số gam dung dịch HCL 14,6% cần dùng và thể tích khí h2 thoát ra ở điều kiện tiêu chuẩn
Theo gt ta có: $n_{Zn}=0,06(mol)$
$Zn+2HCl\rightarrow ZnCl_2+H_2$
a, Ta có: $n_{HCl}=0,12(mol)\Rightarrow m_{ddHCl}=30(g)$
b, Ta có: $n_{H_2}=0,06(mol)\Rightarrow V_{H_2}=1,344(l)$
Đúng 2
Bình luận (0)
a)
n Zn = 3,9.65 = 0,06(mol)
Zn + 2HCl $\to$ ZnCl2 + H2
Theo PTHH :
n HCl = 2n Zn =0,12(mol)
=> mdd HCl = 0,12.36,5/14,6% = 30(gam)
n H2 = n Zn = 0,06(mol)
V H2 = 0,06.22,4 = 1,344 lít
Đúng 1
Bình luận (0)
nZn=0,06(mol)nZn=0,06(mol)
Zn+2HCl→ZnCl2+H2Zn+2HCl→ZnCl2+H2
a, Ta có: nHCl=0,12(mol)⇒mddHCl=30(g)nHCl=0,12(mol)⇒mddHCl=30(g)
b, Ta có: nH2=0,06(mol)⇒VH2=1,344(l)
Đúng 0
Bình luận (0)
Hòa tan hoàn toàn 26 gam kẽm vào dung dịch axit Clohidric a viết phương trình hóa học của phản ứng b tính khối lượng HCl cần dùng c tính thể tích khí hidro ( điều kiện tiêu chuẩn) thu được sau phản ứng
\(n_{Zn}=\dfrac{26}{65}=0.4\left(mol\right)\)
\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
\(0.4.......0.8....................0.4\)
\(m_{HCl}=0.8\cdot36.5=29.2\left(g\right)\)
\(V_{H_2}=0.4\cdot22.4=8.96\left(l\right)\)
Đúng 2
Bình luận (0)
Cho 6,5 kẽm tác dụng hoàn toàn với 200ml dung dịch HCl thu được dung dịch muối kẽm clorua và khí hidro ( dktc)
a) TÍnh thể tích khí H2 sinh ra ( ở dktc)
b) tính nồng độ mol của dung dịch HCl đã dùng
c) Dẫn toàn bộ lượng khí hidro thu được đi qua 20g bột CuO nung nóng. Tính khối lượng đồng thu được sau phản ứng
\(n_{Zn}=\dfrac{6,5}{65}=0,1\left(mol\right)\)
\(n_{CuO}=\dfrac{20}{80}=0,25\left(mol\right)\)
PTHH: Zn + 2HCl ---> ZnCl2 + H2
0,1---->0,1----------------->0,1
=> \(\left\{{}\begin{matrix}V_{H_2}=0,1.22,4=2,24\left(l\right)\\C_{M\left(HCl\right)}=\dfrac{0,2}{0,2}=1M\end{matrix}\right.\)
PTHH: CuO + H2 --to--> Cu + H2O
LTL: 0,25 > 0,1 => CuO dư
Theo pthh: nCu = nH2 = 0,1 (mol)
=> mCu = 0,1.64 = 6,4 (g)
Đúng 3
Bình luận (0)
\(n_{Zn}=\dfrac{6,5}{65}=0,1\left(mol\right)\\
pthh:Zn+2HCl\rightarrow ZnCl_2+H_2\)
0,1 0,2 0,2
\(V_{H_2}=0,2.22,4=4,48l\\
C_M=\dfrac{0,2}{0,2}=1M\\
n_{CuO}=\dfrac{20}{80}=0,25\left(G\right)\\
pthh:CuO+H_2\underrightarrow{t^o}Cu+H_2O\\
LTL:0,25>0,1\)
=>CuO dư
\(n_{Cu}=n_{H_2}=0,1\left(mol\right)\\
m_{Cu}=0,1.64=6,4g\)
Đúng 0
Bình luận (0)
\(Cho 6,5 g Zn tác dụng vừa đủ với dung dịch HCl 7,3% a Tính thể tích khí H2 sinh ra ở điều kiện tiêu chuẩn b Tính khối lượng dung dịch HCl đã dùng c Tính C% muối thu được\)
PTPỨ: Zn + 2HCl ---> ZnCl2 + H2
nZn = 6,5/65 = 0,1 (mol)
Theo ptpứ: nHCl = 2nZn = 0,2 (mol)
=> mHCl = 0,2 x 36,5 = 7,3 (g)
nH2 = nZn = 0,1 (mol)
=> VH2(đktc) = 0,1 x 22,4 = 2,24 (l)
mdd HCl đã dùng = 7,3 x 7,3% = 0,5329(g)
Câu c bạn viết rõ ra đi ak. CM hay C% và của chất j
Đúng 0
Bình luận (0)
Hòa tan m gam kẽm vào 200ml dung dịch HCl 2M. S au phản ứng thu được kẽm clorua và khí hidro
a. Viết phương trình phản ứng xảy ra
b. Tính m
c. Tính khối lượng kẽm clorua trở thành
d. Tính thể tích khí ở điều kiện tiêu chuẩn
\(n_{HCl}=0,2.2=0,4\left(mol\right)\\ a.Zn+2HCl\rightarrow ZnCl_2+H_2\\ b.0,2........0,4.......0,2.......0,2\left(mol\right)\\ m=m_{Zn}=0,2.65=13\left(g\right)\\ c.m_{ZnCl_2}=136.0,2=27,2\left(g\right)\\ d.V_{H_2\left(đktc\right)}=0,2.22,4=4,48\left(l\right)\)
Đúng 0
Bình luận (0)
Hòa tan 13 gam Kẽm cần vừa đủ 500ml dung dịch HCL có nồng độ Cm a) tính nồng độ dung dịch HCL đã dùng b) tính khối lượng muối tạo thành và thể tích H2 sinh ra ở điều kiện tiêu chuẩn c) nếu cho lượng axít trên vào 200 gam dung dịch KOH 5,6% sau đó cho mẫu quỳ tím vào dung dịch thu được sau phản ứng thì màu của quỳ tím thế nào? giải thích
\(n_{Zn}=\dfrac{m_{Zn}}{M_{Zn}}=\dfrac{13}{65}=0,2mol\)
PTHH: Zn + 2HCl \(\rightarrow\) ZnCl2 + H2
TL: 1 : 2 : 1 : 1
mol: 0,2 \(\rightarrow\) 0,1 \(\rightarrow\) 0,2 \(\rightarrow\) 0,2
đổi 500ml = 0,5 l
\(a.C_{M_{ddHCl}}=\dfrac{n_{HCl}}{V_{HCl}}=\dfrac{0,1}{0,5}=0,2M\)
\(b.m_{ZnCl_2}=n.M=0,2.136=27,2g\)
\(V_{H_2}=n.22,4=0,2.22,4=4,48l\)
c.
Màu của quỳ tím sẽ chuyển sang màu đỏ.
Giải thích:
- Phản ứng giữa axit HCl và bazơ KOH tạo ra muối KCl và nước: HCl + KOH → KCl + H2O
- Vì dung dịch KOH là bazơ, nên khi phản ứng với axit HCl thì sẽ tạo ra dung dịch muối KCl và nước.
- Muối KCl không có tính kiềm, nên dung dịch thu được sẽ có tính axit.
- Khi cho mẫu quỳ tím vào dung dịch axit, quỳ tím sẽ chuyển sang màu đỏ do tính axit của dung dịch.
Đúng 1
Bình luận (0)
\(n_{Zn}=\dfrac{13}{65}=0,2\left(mol\right)\)
Pt : \(Zn+2HCl\rightarrow ZnCl_2+H_2\)
0,2----->0,4------>0,2---->0,2
a) \(C_{MddHCl}=\dfrac{0,4}{0,5}=0,8M\)
b) \(m_{muối}=m_{ZnCl2}=0,2.136=27,2\left(g\right)\)
\(V_{H2\left(dktc\right)}=0,2.22,4=4,48\left(l\right)\)
c) \(n_{KOH}=\dfrac{5,6\%.200}{100\%.56}=0,2\left(mol\right)\)
Pt : \(KOH+HCl\rightarrow KCl+H_2O\)
0,2 0,4
Xét tỉ lệ : \(0,2< 0,4\Rightarrow HCldư\)
Khi cho quỳ tím vào dụng dịch sau phản ứng --> quỳ hóa đỏ (do HCl có tính axit)
Đúng 1
Bình luận (0)
Cho 69,6 gam MnO2 tác dụng với dung dịch HCl đặc dư. Biết phản ứng xảy ra hoàn toàna. Tính thể tích khí H2 thu được ở điều kiện tiêu chuẩn?b. Tính nồng độ mol dung dịch axit cần dùng cho phản ứng. Biết thể tích dung dịch axit ban đầu là 200ml.c. Dẫn toàn bộ lượng khí clo thu được ở trên cho tác dụng hết với 200ml dung dịch NaOH để điều chế nước Javen. Viết PTHH và tính nồng độ mol của dung dịch NaOH cần dùng.
Đọc tiếp
Cho 69,6 gam MnO2 tác dụng với dung dịch HCl đặc dư. Biết phản ứng xảy ra hoàn toàn
a. Tính thể tích khí H2 thu được ở điều kiện tiêu chuẩn?
b. Tính nồng độ mol dung dịch axit cần dùng cho phản ứng. Biết thể tích dung dịch axit ban đầu là 200ml.
c. Dẫn toàn bộ lượng khí clo thu được ở trên cho tác dụng hết với 200ml dung dịch NaOH để điều chế nước Javen. Viết PTHH và tính nồng độ mol của dung dịch NaOH cần dùng.