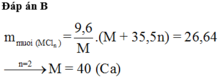Đốt cháy 4,8 g kim loại (ll) trong bình clorual dư thu được 19 gam muối Tìm kim loại

Những câu hỏi liên quan
Đốt cháy hoàn toàn 4,8 gam kim loại M (hóa trị 2) bằng khí chlorine, thu được 19 gam muối chloride.Xác định kim loại M
Áp dụng định luật bảo toàn khối lượng:
`m_(Cl_2)=19-4,8=14,2(g)`
`=>n_(Cl_2)=(14,2)/(71)=0,2(mol)`
PTHH: \(M+Cl_2 \rightarrow MCl_2\) (có điều kiện `t^o)`
Từ đó ta suy ra `n_(M)=0,2(mol)`
`=>M=(4,8)/(0,2)=24`
`=>M` là `Mg` (Magiê)
Đúng 2
Bình luận (0)
Đốt cháy hoàn toàn 4,8 gam một kim loại M hóa trị II trong bình chứa khí clo nguyên chất. Sau khi phản ứng kết thúc, để nguội thì thu được 11,9 gam muối clorua. Kim loại M là
A. Fe.
B. Al.
C. Na.
D. Mg.
Đốt cháy hoàn toàn 4,8 gam một kim loại M hóa trị II trong bình chứa khí clo nguyên chất. Sau khi phản ứng kết thúc, để nguội thì thu được 11,9 gam muối clorua. Kim loại M là
A. Fe.
B. Al.
C. Na.
D. Mg.
Theo ĐLBTKL
\(m_{kimloại}+m_{Cl_2}=m_{muối}=>m_{Cl_2}=11,9-4,8=7,1\left(g\right)\)
\(n_{Cl_2}=\dfrac{m}{M}=7,1:71=0,1\left(mol\right)=>n_M=\dfrac{2}{n}.0,1=\dfrac{0,2}{n}\left(mol\right)\\ =>M=\dfrac{m}{n}=\dfrac{4,8}{\dfrac{0,2}{n}}=24\)
=> Chọn D
Đúng 2
Bình luận (0)
Đốt cháy hoàn toàn 8,4 gam một kim loại trong khí clo dư thu được 24,375 gam muối clorua. Tìm công thức hóa học của kim loại
Giả sử KL cần tìm là A có hóa trị n.
PT: \(2A+nCl_2\underrightarrow{t^o}2ACl_n\)
Theo ĐLBT KL: mKL + mCl2 = m muối
⇒ mCl2 = 24,375 - 8,4 = 15,975 (g)
\(\Rightarrow n_{Cl_2}=\dfrac{15,975}{71}=0,225\left(mol\right)\)
Theo PT: \(n_A=\dfrac{2}{n}n_{Cl_2}=\dfrac{0,45}{n}\left(mol\right)\)
\(\Rightarrow M_A=\dfrac{8,4}{\dfrac{0,45}{n}}=\dfrac{56}{3}n\left(g/mol\right)\)
Với n = 3 thì MA = 56 (g/mol)
Vậy: A là Fe.
Đúng 2
Bình luận (0)
Đốt cháy hoàn toàn 12,48 gam kim loại M trong khí Cl2 dư, thu được 38,04 gam muối. Kim loại M là
A. Fe
B. Mg
C. Al
D. Cr
Đốt cháy hoàn toàn 4,8 gam kim loại R có hóa trị II bằng khí oxi dư, thu được 8 gam oxit. Kim loại R là
A. Sr
B. Mg
C. Ca
D. Zn
Đốt cháy hết 2,275 gam một kim loại X trong bình chứa khí Clo. Để nguội bình, thu được 4,76 gam một muối clorua của kim loại X. Xác định tên của kim loại X đem đốt.
\(2X+nCl_2\rightarrow2XCl_n\)
2,275/X -> 4,76/X+35,5n
\(\dfrac{2.275}{X}=\dfrac{4.76}{X+35.5n}\)
=>\(\Leftrightarrow\dfrac{X}{X+35.5n}=\dfrac{2.275}{4.76}=\dfrac{65}{136}\)
=>136X=65X+2307,5n
=>71X=2307,5n
=>X=32,5n
Ta sẽ thấy n=2 phù hợp
=>X=65
=>X là Zn
Đúng 1
Bình luận (1)
Đốt cháy 13gam một kim loiaj hóa trị ll trong oxi dư,thu được 16,2 gam chất rắn.xác định kim loại đó
\(pthh:2A+O_2\overset{t^o}{--->}2AO\)
Ta có: \(m_{O_2}=16,2-13=3,2\left(g\right)\)
\(\Rightarrow n_{O_2}=\dfrac{3,2}{32}=0,1\left(mol\right)\)
Theo pt: \(n_A=2.n_{O_2}=2.0,1=0,2\left(mol\right)\)
\(\Rightarrow M_A=\dfrac{13}{0,2}=65\left(\dfrac{g}{mol}\right)\)
Vậy A là kim loại kẽm (Zn)
Đúng 2
Bình luận (0)
Gọi X là kim loại hóa trị II
Pt : \(2X+O_2\underrightarrow{t^o}2XO|\)
2 1 2
0,2 0,1
Theo định luật bảo toàn khối lượng :
\(m_X+m_{O2}=m_{XO}\)
\(13+m_{O2}=16,2\)
\(\Rightarrow m_{O2}=16,2-13=3,2\left(g\right)\)
\(n_{O2}=\dfrac{3,2}{32}=0,1\left(mol\right)\)
\(n_X=\dfrac{0,1.2}{1}=0,2\left(mol\right)\)
⇒ \(M_X=\dfrac{13}{0,2}=65\) (g/mol)
Vậy kim loại X là kẽm
Chúc bạn học tốt
Đúng 1
Bình luận (0)
Đốt cháy hoàn toàn 9,6 gam kim loại M (có hóa trị không đổi) trong khí Cl2 dư, thu được 26,64 gam muối. Kim loại M là
A. K.
B. Ca.
C. Mg.
D. Al.