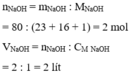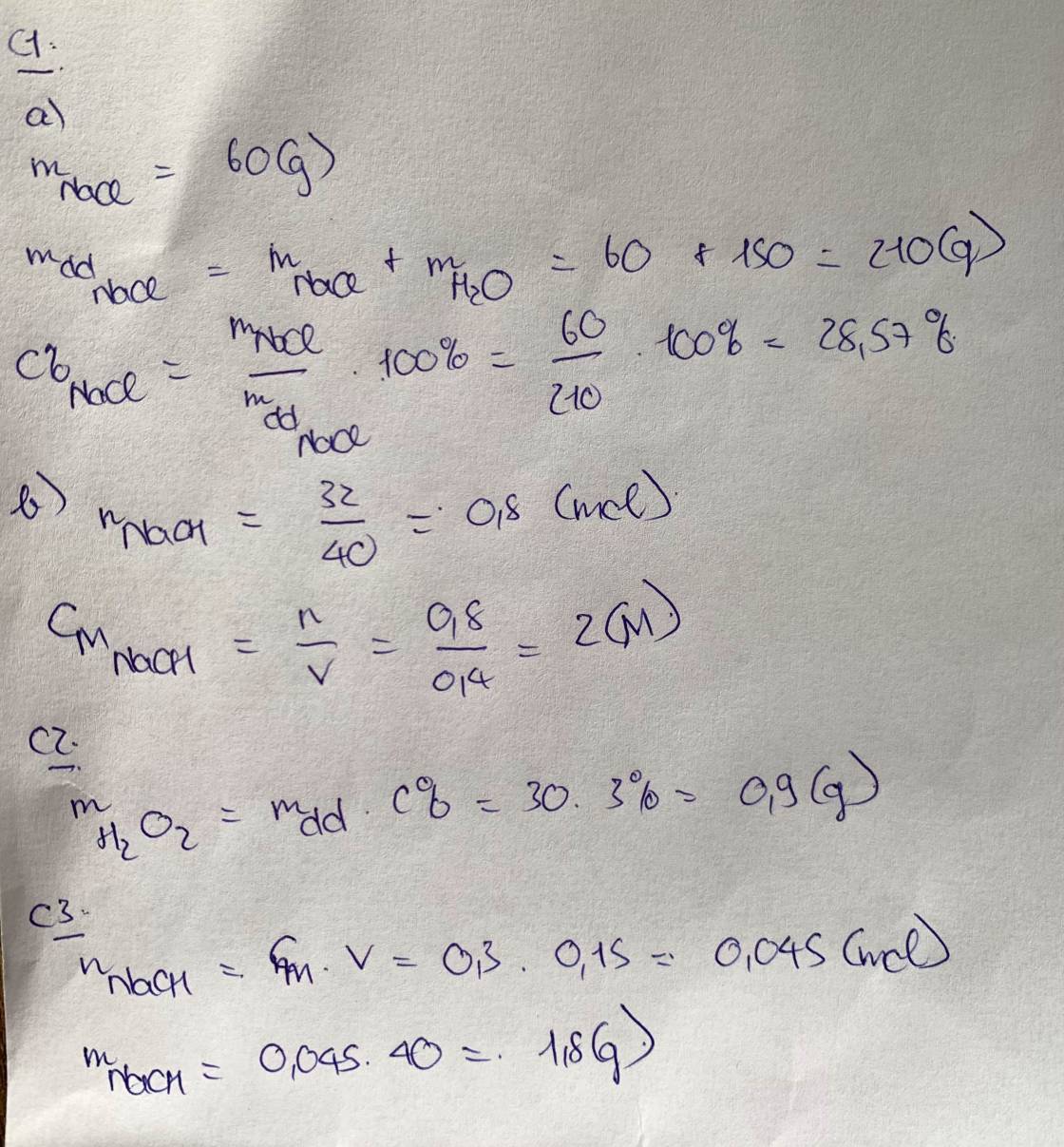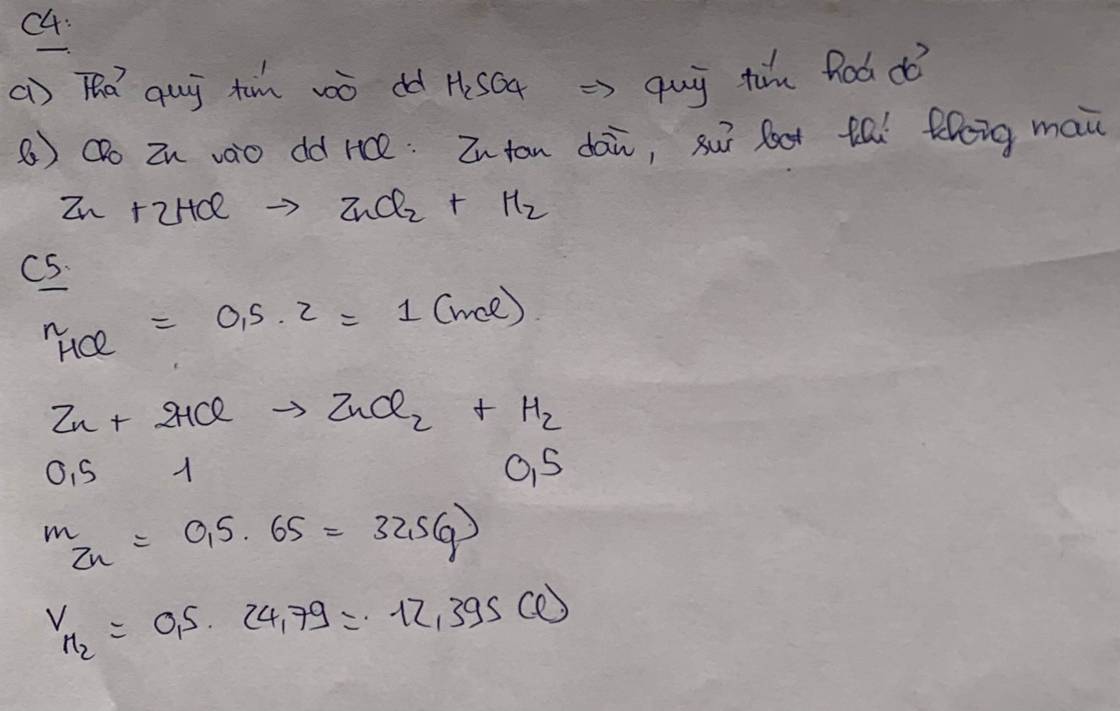tìm thể tích của dung dịch NaOH 5M để trong đó có hòa tan 60g NaOH

Những câu hỏi liên quan
1 .Tìm số mol chất tan có trong 250ml dung dịch HCL 0,5M
2.Tìm khối lượng chất tan có trong 50M dung dịch NaCl 0,1 M
3.Tìm thể tích dung dịch HCL 2M để trong đó có hòa tan0,5 mol HCL
4.Tìm thể tĩhs dung dịch NaOH 5M để trong ddos có hòa tan 60g NaOH
Tìm thể tích của dung dịch NaOH 5M để trong đó có hòa tan 60g NaOH
\(n_{NaOH}=1,5\left(mol\right)\)
\(V=\dfrac{1,5}{5}=0,3\left(l\right)=300\left(ml\right)\)
Đúng 1
Bình luận (0)
\(n_{NaOH\left(ct\right)}=\dfrac{m_{NaOH}}{M_{NaOH}}=1,5\left(mol\right)\)
\(V_{ddNaOH}=\dfrac{n_{ctNaOH}}{C_{M_{NaOH}}}=0,3\left(l\right)\)
Đúng 1
Bình luận (0)
\(n_{NaOH}=\frac{60}{40}=1,5(mol)\\ V_{ddNaOH}=\frac{1,5}{5}=0,3(l)=300(ml)\)
Đúng 1
Bình luận (0)
Hòa tan 80 g NaOH vào nước thu được dung dịch có nồng độ 1M. Thể tích dung dịch NaOH là:
A. 1 lít
B. 2 lít
C. 1,5 lít
D. 3 lít
hòa tan vừa đủ 5,1g Al2O3 trong V lít dung dịch HCl 4M.
a.Tìm giá trị của V
b.Nếu không dùng dung dịch HCl mà dung dịch NaOH 10M thì thể tích dung dịch NaOH cần dùng là bao nhiêu
a)
$n_{Al_2O_3} = \dfrac{5,1}{102} = 0,05(mol)$
$Al_2O_3 + 6HCl \to 2AlCl_3 + 3H_2O$
$n_{HCl} = 6n_{Al_2O_3} = 0,3(mol)$
$\Rightarrow V = \dfrac{0,3}{4} = 0,075(lít)$
b)
$Al_2O_3 + 2NaOH \to 2NaAlO_2 + 2H_2O$
$n_{NaOH} = 2n_{Al_2O_3} = 0,1(mol)$
$V_{dd\ NaOH} = \dfrac{0,1}{10} = 0,01(lít)$
Đúng 5
Bình luận (0)
Trung hòa 100 ml dung dịch CH3COOH 0,3M bằng dung dịch NaOH 1,5M. a) Tính thể tích dung dịch NaOH đã dùng ? b) Tính khối lượng muối thu được sau phản ứng ? c) Tính nồng độ mol của chất tan có trong dung dịch sau phản ứng ( biết thể tích thay đổi không đáng kể) ? Biết C= 12; O= 16; H = 1 ; Na=23
a) \(n_{CH_3COOH}=0,1.0,3=0,03\left(mol\right)\)
PTHH: CH3COOH + NaOH --> CH3COONa + H2O
0,03---->0,03--------->0,03
=> \(V_{dd.NaOH}=\dfrac{0,03}{1,5}=0,02\left(l\right)\)
b) mCH3COONa = 0,03.82 = 2,46 (g)
c) \(C_{M\left(CH_3COONa\right)}=\dfrac{0,03}{0,1+0,02}=0,25M\)
Đúng 2
Bình luận (0)
Hòa tan hoàn toàn 8g CuO vào dung dịch H2SO4 1M. Để trung hòa lượng axit dư trong dung dịch sau phản ứng cần dùng 240ml dung dịch NaOH 0.5M và thu được dung dịch A
a)Thể tích H2SO4 đã dùng?b) Nồng độ mol của các chất trong dung dịch A?
\(n_{CuO}=\dfrac{8}{80}=0.1\left(mol\right)\)
\(CuO+H_2SO_4\rightarrow CuSO_4+H_2O\)
\(0.1...........0.1.........0.1\)
\(n_{NaOH}=0.24\cdot0.5=0.12\left(mol\right)\)
\(2NaOH+H_2SO_4\rightarrow Na_2SO_4+H_2O\)
\(0.12..........0.06\)
\(n_{H_2SO_4}=0.1+0.06=0.16\left(mol\right)\)
\(V_{dd_{H_2SO_4}}=\dfrac{0.16}{1}=0.16\left(l\right)\)
\(C_{M_{H_2SO_4\left(dư\right)}}=\dfrac{0.06}{0.16}=0.375\left(M\right)\)
\(C_{M_{CuSO_4}}=\dfrac{0.1}{0.16}=0.625\left(M\right)\)
Đúng 2
Bình luận (1)
Câu 1 a. Hòa tan 60 gam NaCl vào 150 gam nước. Tính nồng độ phần trăm của dung dịch thu được.b.Tính nồng độ mol của dung dịch khi hòa tan 32 gam NaOH trong 400ml nước. (coi thể tích dung dịch không đổi).Câu 2 Hãy tính khối lượng H2O2 có trong 30 g dung dịch nồng 3% .Câu 3 Tính khối lượng của NaOH có trong 300 ml dung dịch có nồng độ 0,15 M.Cho Na 23; O 16; H1.Câu 4Hãy nêu , giải thích được hiện tượng xảy ra trong thí nghiệm và viết phương trình hoá học .Từ đó rút ra nhận xét về tính chất...
Đọc tiếp
Câu 1
a. Hòa tan 60 gam NaCl vào 150 gam nước. Tính nồng độ phần trăm của dung dịch thu được.
b.Tính nồng độ mol của dung dịch khi hòa tan 32 gam NaOH trong 400ml nước. (coi thể tích dung dịch không đổi).
Câu 2 Hãy tính khối lượng H2O2 có trong 30 g dung dịch nồng 3% .
Câu 3 Tính khối lượng của NaOH có trong 300 ml dung dịch có nồng độ 0,15 M.
Cho Na= 23; O= 16; H=1.
Câu 4
Hãy nêu , giải thích được hiện tượng xảy ra trong thí nghiệm và viết phương trình hoá học .Từ đó rút ra nhận xét về tính chất của acid khi thực hiện các thí nghiệm sau:
a.Thả miếng giấy quì tím vào lọ đựng dung dịch sulfuric acid (H2SO4)
b.Cho viên kẽm (zinc) vào trong ống nghiệm có chứa dung dịch hydrochloric acid.
Câu 5
Cho kẽm (Zinc) dư tác dụng với 500 ml dung dịch hydrochloric acid 2 M, thu được V (lít) khí hydrogen (250C và 1 bar).
Tính khối lượng kẽm đã phản ứng và thể tích khí hydrogen thu được.
Hòa tan hoàn toàn 13,8g Na vào nước lấy dư thu đc dung dịch bão hòa NaOH và khí hidro
a. Viết PTHH.
b. Tính thể tích H2 thu đc ở đktc.
c. Giả sử ban đầu dùng 286,8 g nước để hòa tan. Tính nồng độ phần trăm của dd NaOH
\(n_{Na}=\dfrac{13,8}{23}=0,6\left(mol\right)\\ pthh:Na+H_2O\rightarrow NaOH+\dfrac{1}{2}H_2\)
0,6 0,6 0,3
\(V_{H_2}=0,3.22,4=6,72\left(l\right)\\ c,m_{\text{dd}}=13,8+286,8-\left(0,3.2\right)=300\left(g\right)\\ C\%=\dfrac{0,6.40}{300}.100\%=8\%\)
Đúng 2
Bình luận (0)
\(n_{Na}\) = \(\dfrac{13,8}{23}\) = 0,6 mol
Theo PTHH:
a) \(2Na+2H_2O\underrightarrow{t^o}2NaOH+H_2\)
2 2 2 1 (mol)
0,6 \(\rightarrow\) 0,6 \(\rightarrow\) 0,6 \(\rightarrow\) 0,3 (mol)
b) \(V_{H_2}\) = 0,3.22,4 = 6,72l
c) \(m_{dd}\) = 13,8 + 286,8 - 0,3.2 = 300g
\(C\%\) = \(\dfrac{0,6.40}{300}\).100% = 8%
Đúng 1
Bình luận (0)
Có 200g dung dịch NaOH 5% (dung dịch A). Cần hòa tan bao nhiêu gam NaOH vào dung dịch A để có dung dịch A để có dung dịch NaOH 8%?
Gọi lượng NaOH cần hòa tan vào dd A là x (g)
Ta có công thức :
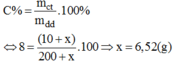
Vậy phải trộn thêm 6,52g NaOH vào dung dịch A để được dung dịch A để được dung dịch NaOH 8%.
Đúng 1
Bình luận (0)