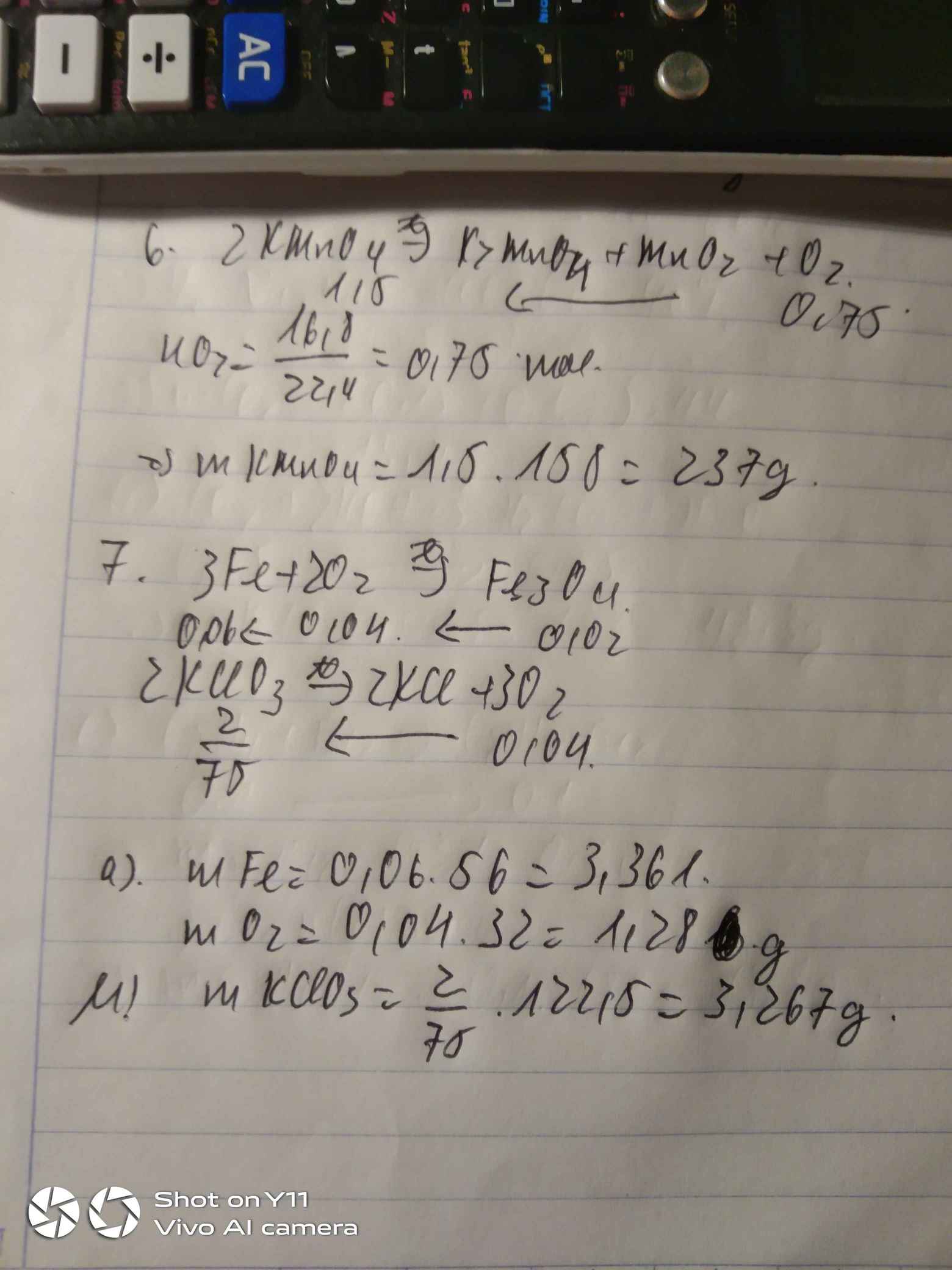Muốn điều chế 16 gam khí oxi thì phải nung bao nhiêu gam KMnO4

Những câu hỏi liên quan
Câu 25: Muốn điều chế được 3,36 lít khí oxi (đktc) thì khối lượng KMnO4 cần nhiệt phân là bao nhiêu? (Cho: O 16, K 39, Mn 55) A.23,7 gam. B.47,4 gam. C.42,4 gam D. 24,7 gam.Câu 26: Đốt cháy 12,4g photpho trong bình chứa 17g khí oxi tạo thành điphotpho pentaoxit P2O5. Khối lượng sản phẩm tạo thành là (Cho: P 31, O 16)A.56,8 gam.B.42,6 gam. C.71 gam. D.28,4 gam.Câu 27: Cho 4,7 gam K2O tác dụng hoàn toàn với H2O theo phản ứng. K2O + H2O ---[Math Processing Error]→ KOHKhối...
Đọc tiếp
Câu 25: Muốn điều chế được 3,36 lít khí oxi (đktc) thì khối lượng KMnO4 cần nhiệt phân là bao nhiêu? (Cho: O = 16, K = 39, Mn = 55)
A.23,7 gam.
B.47,4 gam.
C.42,4 gam
D. 24,7 gam.
Câu 26: Đốt cháy 12,4g photpho trong bình chứa 17g khí oxi tạo thành điphotpho pentaoxit P2O5. Khối lượng sản phẩm tạo thành là (Cho: P = 31, O = 16)
A.56,8 gam.
B.42,6 gam.
C.71 gam.
D.28,4 gam.
Câu 27: Cho 4,7 gam K2O tác dụng hoàn toàn với H2O theo phản ứng.
K2O + H2O ---[Math Processing Error]→ KOH
Khối lượng KOH thu được sau phản ứng là: (Cho: K = 39, O = 16, H = 1)
A.6,5 gam.
B.6 gam.
C.5 gam.
D.5,6 gam.
Câu 1. Muốn điều chế được 4,48 lít khí oxi (đktc) thì khối lượng KMnO4 cần nhiệt phân là bao nhiêu? (Cho nguyên tử khối: O 16, K 39, Mn 55)Câu 2. Đốt cháy 6,2 gam photpho với 6,4 gam oxi trong không khí, sản phẩm thu được là điphotpho pentaoxit (P2O5).a. Viết PTHH của phản ứng.b. Sau phản ứng chất nào còn dư và số mol chất còn dư là bao nhiêu?b. Tính khối lượng sản phẩm tạo thành.
Đọc tiếp
Câu 1. Muốn điều chế được 4,48 lít khí oxi (đktc) thì khối lượng KMnO4 cần nhiệt phân là bao nhiêu? (Cho nguyên tử khối: O = 16, K = 39, Mn = 55)
Câu 2. Đốt cháy 6,2 gam photpho với 6,4 gam oxi trong không khí, sản phẩm thu được là điphotpho pentaoxit (P2O5).
a. Viết PTHH của phản ứng.
b. Sau phản ứng chất nào còn dư và số mol chất còn dư là bao nhiêu?
b. Tính khối lượng sản phẩm tạo thành.
C1:
nO2 = 4,48/22,4 = 0,2 (mol)
PTHH: 2KMnO4 -> (t°) K2MnO4 + MnO2 + O2
nKMnO4 = 0,2 . 2 = 0,4 (mol)
mKMnO4 = 0,4 . 158 = 63,2 (g)
C2:
nP = 6,2/31 = 0,2 (mol)
nO2 = 6,4/32 = 0,2 (mol)
PTHH: 4P + 5O2 -> (t°) 2P2O5
LTL: 0,2/4 > 0,2/5 => P dư
nP2O5 = 0,2/5 . 2 = 0,08 (mol)
mP2O5 = 0,08 . 142 = 11,36 (g)
Đúng 3
Bình luận (0)
Trong phòng thí nghiệm, muốn điều chế 17,92 lít khí O2 ( đktc) thì cần dùng bao nhiêu gam KMnO4?
nO2 = \(\dfrac{17,92}{22,4}\)= 0,8 mol
2KMnO4 to→ K2MnO4 + O2 + MnO2
Theo phương trình phản ứng, để thu được 0,8 mol hay 17,92 lít O2 thì cần 0,8.2 = 1,6 mol KMnO4
=> mKMnO4 = 1,6.(39+55+16.4) = 252,8 gam
Đúng 2
Bình luận (0)
Để điều chế khí oxi, người ta nung a gam KMnO4. Sau một thời gian nung ta thu được 100 gam chất rắn A và 6,72 lít khí O2 (đo ở điều kiện tiêu chuẩn). a. Viết phương trình phản ứng xảy ra khi nung KMnO4. b. Tính khối lượng KMnO4 ban đầu. c. Tính thành phần phần trăm theo khối lượng các chất trong A.
\(a,PTHH:2KMnO_4\rightarrow^{t^o}K_2MnO_4+MnO_2+O_2\\ b,n_{O_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\\ \Rightarrow m_{O_2}=0,3\cdot32=9,6\left(g\right)\\ \Rightarrow m_{KMnO_4\left(bđ\right)}=m_{\text{chất rắn}}+m_{O_2}=109,6\left(g\right)\\ c,n_{MnO_2}=0,3\left(mol\right)\\ \Rightarrow m_{MnO_2}=0,3\cdot87=26,1\left(g\right)\\ \Rightarrow\%_{MnO_2}=\dfrac{26,1}{100}\cdot100\%=26,1\%\\ \Rightarrow\%_{KMnO_4}=100\%-26,1\%=73,9\%\)
Đúng 1
Bình luận (0)
Bài 6: Nung nóng Kali pemanganat KMnO4 thu được K2MnO4, MnO2 và khí O2. Hãy tính khối lượng KMnO4 cần thiết để điều chế 16,8 lít khí oxi (đktc).Bài 7: a, Tính số gam sắt và oxi cần dung để điều chế 4,64g oxit sắt từ Fe3O4. b, Tính số gam Kali clorat KClO3 cần dùng để có lượng oxi dùng cho phản ứng trên.
Đọc tiếp
Bài 6: Nung nóng Kali pemanganat KMnO4 thu được K2MnO4, MnO2 và khí O2. Hãy tính khối lượng KMnO4 cần thiết để điều chế 16,8 lít khí oxi (đktc).
Bài 7: a, Tính số gam sắt và oxi cần dung để điều chế 4,64g oxit sắt từ Fe3O4. b, Tính số gam Kali clorat KClO3 cần dùng để có lượng oxi dùng cho phản ứng trên.
Câu 6.
\(n_{O_2}=\dfrac{16,8}{22,4}=0,75mol\)
\(2KMnO_4\underrightarrow{t^o}K_2MnO_4+MnO_2+O_2\)
1,5 0,75
\(m_{KMnO_4}=1,5\cdot158=237g\)
Câu 7.
\(n_{Fe_3O_4}=\dfrac{4,64}{232}=0,02mol\)
\(3Fe+2O_2\underrightarrow{t^o}Fe_3O_4\)
0,04 0,02
\(2KClO_3\underrightarrow{t^o}2KCl+3O_2\)
\(\dfrac{2}{75}\) 0,04
\(m_{KClO_3}=\dfrac{2}{75}\cdot122,5=\dfrac{49}{15}\approx3,27g\)
Đúng 3
Bình luận (1)
Bài 6 :
\(n_{O_2}=\dfrac{16.8}{22,4}=0,75\left(mol\right)\)
PTHH : 2KMnO4 ----t0-----> K2MnO4 + MnO2 + O2
1,5 0,75
\(m_{KMnO_4}=1,5.158=237\left(g\right)\)
Đúng 2
Bình luận (0)
Xem thêm câu trả lời
Cần bao nhiêu gam KMnO4 để điều chế được lượng khí oxi đốt cháy vừa hết 11,2 lít khí CH4 (đktc) ?
Xem chi tiết
nCH4 = 11.2/22.4 = 0.5 Mol
CH4 + 2O2 -to-> CO2 + 2H2O
0.5____1
2KMnO4 -to-> K2MnO4 + MnO2 + O2
2_____________________________1
mKMnO4 = 2 *158 = 316 (g)
Đúng 1
Bình luận (0)
câu 9 : trong phòng thí nghiệm điều chế khí oxi bằng cách nhiệt phân muối kaliclorat
a) viết phương trình phản ứng
b) muốn điều chế 4,48 gam khí oxi (đktc) cần dùng bao nhiêu gam KCLO3 sau phản ứng thu được bao nhiêu gam chất rắn
a) 2KClO3 (7/75 mol) \(\underrightarrow{t^o}\) 2KCl (7/75 mol) + 3O2\(\uparrow\) (0,14 mol).
b) Số mol khí oxi là 4,48/32=0,14 (mol).
Khối lượng kali clorat cần dùng là 7/75.122,5=343/30 (g).
Khối lượng chất rắn thu được là 7/75.74,5=1043/150 (g).
Đúng 1
Bình luận (0)
\(a,PTHH:2KClO_3\underrightarrow{t^o,MnO_2}2KCl+3O_2\uparrow\\ b,n_{O_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\\ Theo.pt:n_{KClO_3}=\dfrac{2}{3}n_{O_2}=\dfrac{2}{3}.0,2=\dfrac{2}{15}\left(mol\right)\\ m_{KClO_3}=\dfrac{2}{15}.122,5=\dfrac{49}{3}\left(g\right)\)
Đúng 3
Bình luận (0)
Trong phòng thí nghiệm, người ta thường dùng KMnO4, KClO3 để điều chế oxi.
1. Nêu và giải thích phương pháp thu khí oxi vào lọ?
2. Khi nung nóng lần lượt a gam KMnO4 và b gam KClO3 sau phản ứng hoàn toàn thu được cùng một lượng khí oxi. Hãy tính tỉ lệ a/b?
-thu oxi có 2 loại
-Đẩy kk ; là ta lật ngửa bình để thu=>O2 nặng hơn kk
-Đẩy nước : ta có thể dời nước =>O2 ko tan trong nước , ko td vs nước
2
cùng 1 lượng oxi
2KMNO4-to>K2MnO4+MnO2+O2
2KClO3-to>2KClO3+3O2
=>\(\dfrac{a}{b}=\dfrac{2.158}{2\backslash3.122,5}=3.869\)
Đúng 2
Bình luận (0)
thu khí O2 bằng 2pp :
đẩy nước vì O2 ít tan trong nước
đẩy KK bằng cách đặt ngửa bình vì O2 nhẹ hơn KK
gọi nO2 là x
\(pthh:2KMnO_4\underrightarrow{t^o}K_2MnO_4+MnO_2+O_2\)
2x x
\(2KClO_3\underrightarrow{t^o}2KCl+3O_2\)
\(\dfrac{2}{3}x\) x
=> \(\left\{{}\begin{matrix}m_{KMnO_4}=2x.158=316x\\m_{KClO_3}=\dfrac{2}{3}x.122,5=81,6x\end{matrix}\right.\)
=> \(\dfrac{a}{b}=\dfrac{316x}{81,6x}=\dfrac{395}{102}\)
Đúng 1
Bình luận (0)
Muốn điều chế được 3,36 lít khí oxi dktc thì khối lượng KMnO4 cần nhiệt phân là bao nhiêu Viết phương trình điều chế
Xem chi tiết
\(n_{O_2}=\dfrac{3.36}{22.4}=0.15\left(mol\right)\)
\(2KMnO_4\underrightarrow{t^0}K_2MnO_4+MnO_2+O_2\)
\(0.3............................................0.15\)
\(m_{KMnO_4}=0.3\cdot158=47.4\left(g\right)\)
Đúng 2
Bình luận (0)
\(n_{O_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
\(2KMnO_4\xrightarrow[]{t^o}K_2MnO_4+MnO_2+O_2\)
\(0,3\) \(0,15\) \(\left(mol\right)\)
\(m_{KMnO_4}=0,3.158=47,4\left(g\right)\)
Đúng 1
Bình luận (0)