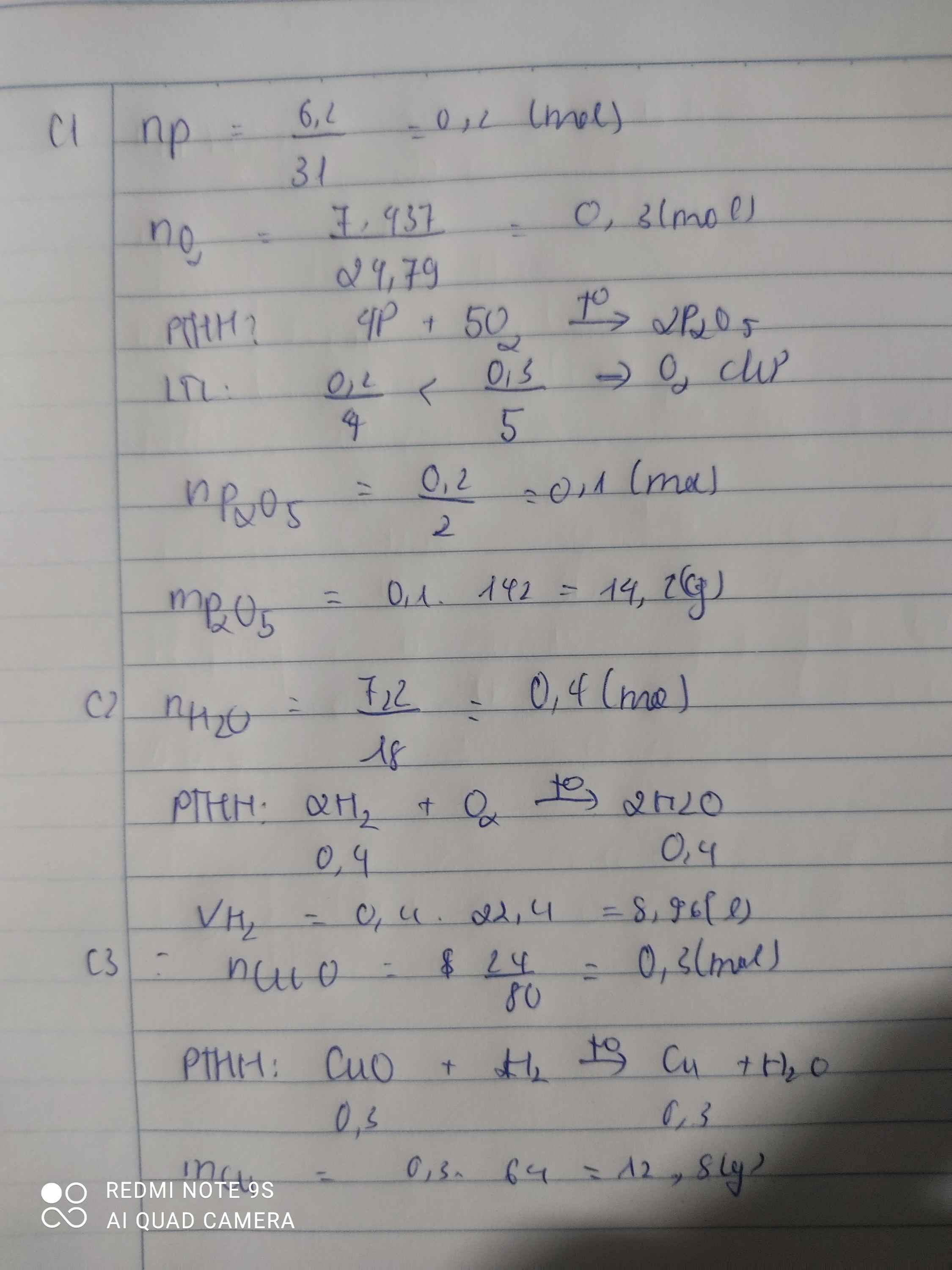đốt cháy 24.8g P trong O2 thì thu được P2O5 a. tính V O2 cần dùng (đktc) b. tính khối lượng sản phẩm tạo thành c. cần lấy bao nhiêu gam KMnO4 để thu được lượng O2 trên

Những câu hỏi liên quan
Đốt cháy hoàn toàn 5,4 g nhôm trong bình chứa khí O2
a. tính thể tích khí O2 cần dùng ở đktc
b. tính khối lượng sản phẩm tạo thành
c. để thu được lượng oxi trên cần bao nhiêu gam KMnO4
a)\(n_{Al}=\dfrac{5,4}{27}=0,2\left(m\right)\)
\(PTHH:4Al+3O_2\underrightarrow{t^o}2Al_2O_3\)
tỉ lệ :4 3 2
số mol :0,2 0,15 0,1
\(V_{O_2}=0,15.22,4=3,36\left(l\right)\)
b)\(m_{Al_2O_3}=0,1.102=10,2\left(g\right)\)
c)\(PTHH:2KMnO_4\underrightarrow{t^o}K_2MnO_4+MnO_2+O_2\)
tỉ lệ :2 1 1 1
số mol :0,3 0,15 0,15 0,15
\(m_{KMnO_4}=0,3.126=37,8\left(g\right)\)
Đúng 0
Bình luận (0)
Đốt cháy photpho trong 4,48 lít O2
a) tính khối lượng sản phẩm thu được
b) tính khối lượng Photpho đã phản ứng
c) cần bao nhiêu gam KMnO4 để điều chế lượng khí Oxi trên
nO2 = 4.48/22.4 = 0.2 (mol)
4P + 5O2 -to-> 2P2O5
0.16__0.2______0.08
mP2O5 = 0.08*142= 11.36(g)
mP=0.16*31=4.96 (g)
2KMnO4 -to-> K2MnO4 + MnO2 + O2
0.4_________________________0.2
mKMnO4 = 0.4*158=63.2 (g)
Đúng 2
Bình luận (0)
a, Tính thể tích khí O2( đktc), thể tích không khí cần dùng để đốt cháy hoàn toàn 8,4 gam etilen b, Sản phẩm tạo thành dẫn qua dung dịch nước vôi trong. Tính khối lượng kết tủa thu được
nC2H4 = 8.4/0.3 (mol)
C2H4 + 3O2 -to-> 2CO2 + 2H2O
0.3_____0.9______0.6
VO2 = 0.9*22.4 = 20.16 (l)
Ca(OH)2 + CO2 => CaCO3 + H2O
__________0.6______0.6
mCaCO3 = 0.6*100 = 60 (g)
Đúng 1
Bình luận (0)
Đốt cháy 5,4 gam Al trong bình đựng 4,48 lít khí O2(đktc)
a. Chất nào còn dư sau phản ứng? khối lượng bằng bao nhiêu?
b. Tính khối lượng KMnO4 đã bị nhiệt phân để thu được lượng O2 nói trên.
nAl=\(\dfrac{5,4}{27}\)=0,2mol
nO2=\(\dfrac{4,48}{22,4}\)=0,2mol
PTHH:
4Al + 3O2--to->2Al2O3
Tỉ lệ \(\dfrac{0,2}{4}\) <\(\dfrac{0,2}{3}\)->Al hết O2 dưtính theo Al
=>m O2=\(\dfrac{1}{60}\).32=\(\dfrac{8}{15}\)g
2KMnO4-to>K2MnO4+MnO2+O2
0,4--------------------------------------0,2
m KMnO4=0,4.158=63,2g
.
Đúng 3
Bình luận (0)
Câu 5: Đốt cháy a gam Zn trong bình đựng 6,72 lít không khí vừa đủ (đktc) thu được x gam sản phẩm (là hợp chất của Zn và oxi).a/ Viết PTHH.b/ Tìm a, x. Biết O2 chiếm 20% thể tích không khí.c/ Để có được lượng oxi trên, cần dùng bao nhiêu gam KMnO4, biết khi nung KMnO4 ta có phản ứng sau: KMnO4 à K2MnO4 + MnO2 + O2.
Đọc tiếp
Câu 5: Đốt cháy a gam Zn trong bình đựng 6,72 lít không khí vừa đủ (đktc) thu được x gam sản phẩm (là hợp chất của Zn và oxi).
a/ Viết PTHH.
b/ Tìm a, x. Biết O2 chiếm 20% thể tích không khí.
c/ Để có được lượng oxi trên, cần dùng bao nhiêu gam KMnO4, biết khi nung KMnO4 ta có phản ứng sau: KMnO4 à K2MnO4 + MnO2 + O2.
\(n_{O_2}=\dfrac{6,72}{5.22,4}=0,06\left(mol\right)\\ PTHH:2Zn+O_2\underrightarrow{t^o}2ZnO\\ Mol:0,03\leftarrow0,06\rightarrow0,03\\ \rightarrow\left\{{}\begin{matrix}a=0,03.65=1,95\left(g\right)\\x=0,03.81=2,43\left(g\right)\end{matrix}\right.\)
\(PTHH:2KMnO_4\underrightarrow{t^o}K_2MnO_4+MnO_2+O_2\uparrow\)
0,12 0,06
\(\rightarrow m_{KMnO_4}=0,12.158=18,96\left(g\right)\)
Đúng 4
Bình luận (1)
Phân hủy hoàn toàn 47,4g KMnO4 thu được m (g) chất rắn và V (lít)khí ở (đktc):
a) tính m=?. V=?.
b) Dùng toàn bộ lượng khí O2 thu được ở trên đeể đốt cháy 3,1 (g) P. Sau phản ứng hoàn toàn tính khối lượng P2O5 tạo ra?
2KMnO4-to>K2MnO4+MnO2+O2
0,3-----------------0,15-----0,15------0,15 mol
n KMnO4=\(\dfrac{47,4}{158}\)=0,3 mol
=>mcr=0,15.197.0,15.87=42,6g
=>VO2=0,15.22,4=3,36l
b) 4P+5O2-to>2P2O5
0,1--------------0,05
nP=\(\dfrac{3,1}{31}\)=0,1 mol
->O2 dư
=>m P2O5=0,05.142=7,1g
Đúng 1
Bình luận (0)
mKMnO4 = 47,4/158 = 0,3 (mol)
PTHH: 2KMnO4 -> (t°) K2MnO4 + MnO2 + O2
Mol: 0,3 ---> 0,15 ---> 0,15 ---> 0,15
m = 0,15 . 197 + 0,15 . 87 = 85,2 (g)
V = VO2 = 0,15 . 22,4 = 3,36 (l)
nP = 3,1/31 = 0,1 (mol)
PTHH: 4P + 5O2 -> (t°) 2P2O5
LTL: 0,1/4 < 0,15/5 => O2 dư
nP2O5 = 0,1/2 = 0,05 (mol)
mP2O5 = 0,05 . 142 = 7,1 (g)
mKMnO4 = 47,4/158 = 0,3 (mol)
PTHH: 2KMnO4 -> (t°) K2MnO4 + MnO2 + O2
Mol: 0,3 ---> 0,15 ---> 0,15 ---> 0,15
m = 0,15 . 197 + 0,15 . 87 = 42,6 (g)
V = VO2 = 0,15 . 22,4 = 3,36 (l)
nP = 3,1/31 = 0,1 (mol)
PTHH: 4P + 5O2 -> (t°) 2P2O5
LTL: 0,1/4 < 0,15/5 => O2 dư
nP2O5 = 0,1/2 = 0,05 (mol)
mP2O5 = 0,05 . 142 = 7,1 (g)
Đúng 0
Bình luận (0)
Hòa tan m gam Mg vào dung dịch chứa 0,15 mol axit HCl TÍnh: a/ giá trị m b/ VH2 (đktc) thu được c/ khối lượng muối tạo thành d/ để đốt cháy hết lượng khí H2 thì cần bao nhiêu lít O2 (đktc)
a)
PTHH: Mg + 2HCl --> MgCl2 + H2
0,075<--0,15--->0,075-->0,075
=> m = 0,075.24 = 1,8 (g)
b) VH2 = 0,075.22,4 = 1,68 (l)
c) mMgCl2 = 0,075.95 = 7,125 (g)
d)
PTHH: 2H2 + O2 --to--> 2H2O
0,075->0,0375
=> VO2 = 0,0375.22,4 = 0,84 (l)
Đúng 2
Bình luận (0)
a.b.c.
\(Mg+2HCl\rightarrow MgCl_2+H_2\)
0,075 0,15 0,075 0,075 ( mol )
\(m_{Mg}=0,075.24=1,8g\)
\(V_{H_2}=0,075.22,4=1,68l\)
\(m_{MgCl_2}=0,075.95=7,125g\)
d.\(2H_2+O_2\rightarrow\left(t^o\right)2H_2O\)
0,075 0,0375 ( mol )
\(V_{O_2}=0,0375.22,4=0,84l\)
Đúng 1
Bình luận (0)
Đốt cháy 8,4 gam sắt trong bình chứa khí xoi thu được xoi sắt từ Fe3O4.a) tính thể tích khí xoi cần dùng? b) Tính khối lượng sản phẩm tạo thành? c/Tính khối lượng KMnO4 cần dùng để điều chế được lượng oxi cần dùng cho phản ứng trên? Xin hãy giúp mình...
Xem chi tiết
PT: \(3Fe+2O_2\underrightarrow{t^o}Fe_3O_4\)
a, Ta có: \(n_{Fe}=\dfrac{8,4}{56}=0,15\left(mol\right)\)
Theo PT: \(n_{O_2}=\dfrac{2}{3}n_{Fe}=0,1\left(mol\right)\)
\(\Rightarrow V_{O_2}=0,1.22,4=2,24\left(l\right)\)
b, Theo PT: \(n_{Fe_3O_4}=\dfrac{1}{2}n_{O_2}=0,075\left(mol\right)\)
\(\Rightarrow m_{Fe_3O_4}=0,075.232=17,4\left(g\right)\)
c, PT: \(2KMnO_4\underrightarrow{t^o}KMnO_4+MnO_2+O_2\)
Theo PT: \(n_{KMnO_4}=2n_{O_2}=0,2\left(mol\right)\)
\(\Rightarrow m_{KMnO_4}=0,2.158=31,6\left(g\right)\)
Bạn tham khảo nhé!
Đúng 3
Bình luận (1)
Bài 1 : Đốt cháy 6,2 gam phosphorus trong bình chứa 7,437lít (đkc) khí oxygen, thu được diphosphorus pentaoxide (P2O5). Tính khối lượng P2O5 tạo thành.
Bài 2: Khí H2 cháy trong khí O2 tạo nước. Tính thể tích khí H2 (đkc) cần dùng để thu được 7,2 gam nước.
Bài 3: Cho 24 gam CuO tác dụng hoàn toàn với khí H2 đun nóng, thu được m gam đồng (Cu). Tính giá trị của m.