Từ Bảng 22.2, hãy nhận xét xu hướng biến đổi nhiệt độ sôi của các hydrogen halide. Giải thích.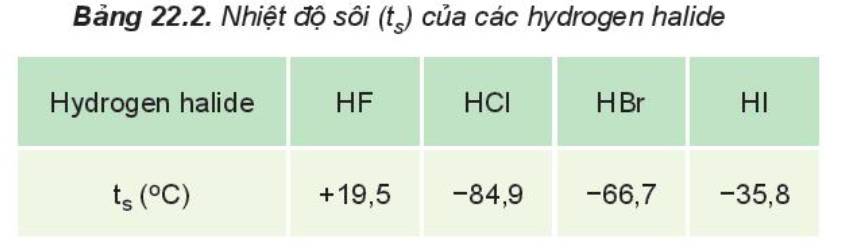

Những câu hỏi liên quan
Từ Bảng 21.2, nhận xét xu hướng biến đổi nhiệt độ nóng chảy, nhiệt độ sôi của các halogen và giải thích.
Nhiệt độ nóng chảy, nhiệt độ sôi tăng từ F2 đến I2 do:
- Tương tác van der Waals giữa các phân tử tăng.
- Khối lượng phân tử tăng.
Đúng 0
Bình luận (0)
Dựa vào Bảng 15.2, em hãy nhận xét về quy luật biến đổi nhiệt độ sôi của alkane theo phân tử khối.
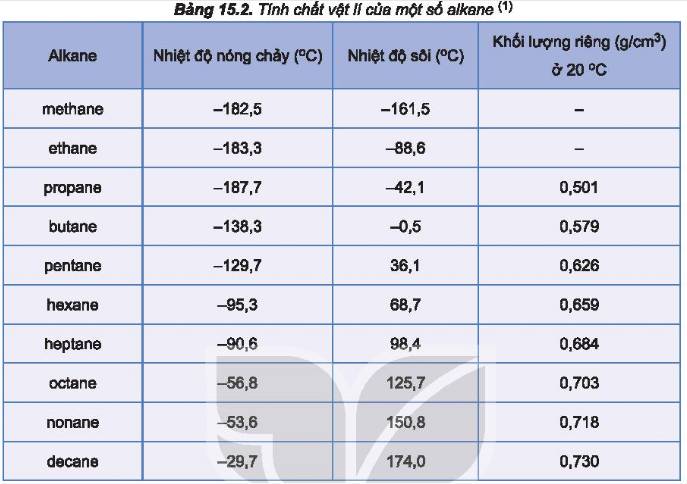
Phân tử khối càng lớn, nhiệt độ sôi càng tăng
Đúng 0
Bình luận (0)
Quan sát biểu đồ thể hiện nhiệt độ sôi của bốn alkane đầu tiên.
a) Nhận xét và giải thích sự biến đổi nhiệt độ sôi của các alkane đã cho trong biểu đồ.
b) Ở nhiệt độ phòng, methane, ethane, propane và butane là những chất lỏng hay chất khí?
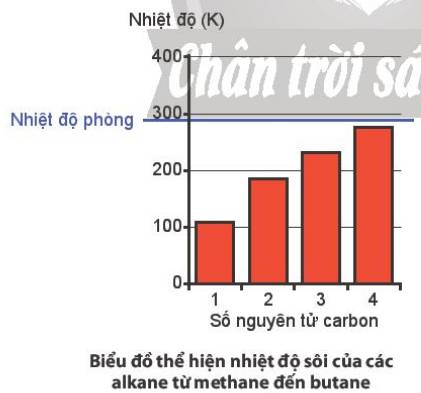
a, Nhiệt độ sôi tăng dần theo độ lớn của PTK
b, Ở nhiệt độ phòng, cả 4 chất này đều là chất khí.
Đúng 1
Bình luận (0)
Hãy giải thích vì sao nhiệt độ sôi của hydrogen bromide cao hơn nhiệt độ sôi của hydrogen chloride.
Nhiệt độ sôi của hydrogen bromide cao hơn nhiệt độ sôi của hydrogen chloride được giải thích như sau:
+ Khối lượng phân tử HBr (81) cao hơn khối lượng phân tử HCl (36,5)
+ Br có bán kính nguyên tử lớn, có nhiều electron hơn Cl => Tăng khả năng lưỡng cực HX => Làm tăng tương tác van der Waals giữa các phân tử
Đúng 0
Bình luận (0)
Dựa vào Bảng 15.2, cho biết xu hướng biến đổi nhiệt độ sôi của các dẫn xuất halogen theo chiều tăng độ dài mạch carbon (cùng loại halogen) và theo chiều tăng nguyên tử khối của halogen từ F, Cl, Br, I (cùng gốc alkyl).
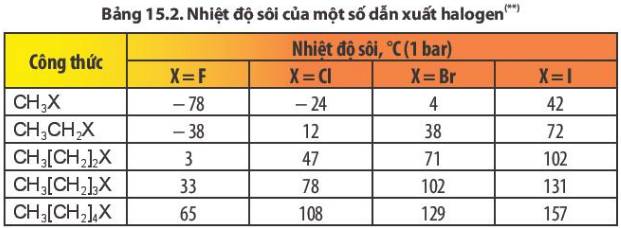
Nhiệt độ sôi của các dẫn xuất halogen tăng dần theo chiều tăng độ dài mạch carbon (cùng loại halogen) và tăng dần theo chiều tăng nguyên tử khối của halogen từ F, Cl, Br, I (cùng gốc alkyl)
Đúng 0
Bình luận (0)
Dựa vào Bảng 18.1 và Hình 18.1, cho biết nhiệt độ sôi của các hydrogen halide từ HCl đến HI biến đổi như thế nào? Giải thích.
Nhiệt độ sôi của các hydrogen halide tăng dần từ HCl đến HI. Nguyên nhân là do khối lượng phân tử tăng, làm tăng năng lượng cần thiết cho quá trình sôi; đồng thời, sự tăng kích thước và số electron trong phân tử, dẫn đến tương tác van der Waals giữa các phân tử tăng
Đúng 1
Bình luận (0)
Nhiệt độ sôi tăng dần từ HCl đến HI
Giải thích:
-M tăng làm tăng năng lượng cần thiết cho quá trình sôi
-sự tăng kích thước và số electron trong phân tử dẫn đến tương tác van der Waals giữa các phân tử tăng.
Đúng 0
Bình luận (0)
Cho nhiệt độ sôi (oC) của một số dẫn xuất halogen trong bảng dưới đây:
X
Cl
Br
I
CH3-X
-24
5
42
C2H5-X
1
38
72
n-C3H7-X
47
71
102
n-C4H9-X
78
102
131
Nhận xét về sự biến đổi nhiệt độ sôi theo chiều tăng mạch cacbon (theo hàng dọc) và theo nguyên tử khối của halogen (hàng ngang). Giải thích sơ bộ.
Đọc tiếp
Cho nhiệt độ sôi (oC) của một số dẫn xuất halogen trong bảng dưới đây:
| X | Cl | Br | I |
| CH3-X | -24 | 5 | 42 |
| C2H5-X | 1 | 38 | 72 |
| n-C3H7-X | 47 | 71 | 102 |
| n-C4H9-X | 78 | 102 | 131 |
Nhận xét về sự biến đổi nhiệt độ sôi theo chiều tăng mạch cacbon (theo hàng dọc) và theo nguyên tử khối của halogen (hàng ngang). Giải thích sơ bộ.
– Theo chiều tăng mạch cacbon (hàng dọc), nguyên từ khối tăng nhiệt độ sôi của các chất tăng dần.
- Khi nguyên tử khối tăng (theo hàng ngang), nhiệt độ sôi cùng giảm dần.
- Khi nguyên tử khối tăng cần tốn nhiều năng lượng để chuyển các phân tử hữu cơ sang trạng thái hơi nhiệt độ sôi tăng.
Đúng 0
Bình luận (0)
Dựa vào bảng số liệu sau:
Nhiệt độ trung bình tại một số địa điểm
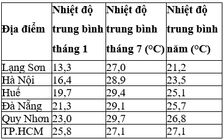
Hãy nhận xét sự thay đổi nhiệt độ từ Bắc vào Nam. Giải thích nguyên nhân.
Nhận xét
Nhiệt độ trung bình tháng 1 và trung bình năm của các địa điểm có sự chênh lệch theo chiều hướng tăng dần từ Bắc vào Nam. Sự chênh lệch rõ nhất là vào tháng 1: Lạng Sơn 13 , 3 o C , TP. Hồ Chí Minh 25 , 8 o C .
Nhiệt độ trung bình tháng 7 giữa các địa điểm ít có sự chênh lệch.
Biên độ nhiệt giảm dần từ Bắc vào Nam.
Nguyên nhân
Càng vào Nam, càng gần xích đạo thì bề mặt Trái Đất càng nhận được lượng bức xạ mặt trời lớn do góc chiếu của tia sáng mặt trời lớn và khoảng thời gian giữa hai lần Mặt Trời qua thiên đỉnh dài hơn.
Tháng 1, chênh lệch nhiệt độ từ Bắc vào Nam rõ rệt vì miền Bắc chịu ảnh hưởng mạnh của gió mùa Đông Bắc.
Tháng 7, không còn tác động của gió mùa Đông Bắc nên sự chênh lệch nhiệt độ giữa các địa điểm từ Bắc vào Nam không rõ rệt. Ở TP. Hồ Chí Minh, nhiệt độ tháng 7 thấp hơn các địa điểm khác vì đây là tháng có mưa lớn (tháng nóng nhất ở TP. Hồ Chí Minh là tháng 4: 28 , 9 o C ).
Đúng 0
Bình luận (0)
Dựa vào xu hướng biến đổi tính chất của các đơn chất halogen trong bảng 17.3, hãy dự đoán về thể (trạng thái) của đơn chất astatine ở điều kiện thường. Giải thích.
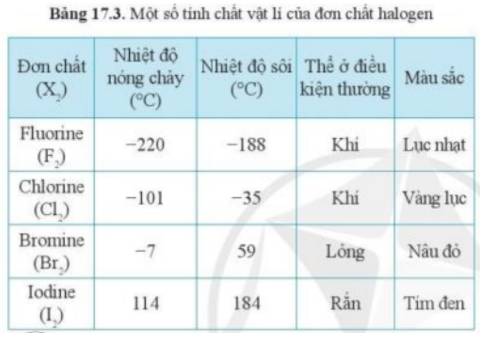
- Theo bảng 17.3, xu hướng biến đổi trạng thái của các halogen ở điều kiện thường từ: khí → lỏng → rắn
- Mà astatine đứng dưới cùng trong nhóm halogen
=> Astatine tồn tại ở thể rắn trong điều kiện thường
- Giải thích: Do sự tăng khối lượng phân tử và sự tăng tương tác van dể Waals
Đúng 0
Bình luận (0)

















