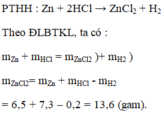cho 13 gram kẽm tác dụng vừa đủ với axit clohđric ̣sau phản ứng thu được kẽm clorua ZnCl2 và kí hidro

Những câu hỏi liên quan
cho 13 gram kẽm tác dụng vừa đủ với axit clohđric ̣sau phản ứng thu được kẽm clorua ZnCl2 và kí hidro
a) tính thể tích khí h2 thoát ra (đktc)
a) \(n_{Zn}=\dfrac{m}{M}=\dfrac{13}{65}=0,2\left(mol\right)\)
PTHH: Zn + 2HCl ---> ZnCl2 + H2
Theo PT: \(n_{H_2}=n_{Zn}=0,2\left(mol\right)\)
=> \(V_{H_2}=n.22,4=0,2.22,4=4,48\left(l\right)\)
Đúng 1
Bình luận (0)
cho 3,5 gam kẽm Zn tác dụng vừa đủ với dung dịch axit clohidro HCl thu được kẽm clorua ZnCl2 và khí hidro H2a. Viết chương trình phản ứng hóa học xảy ra b. Tính thể tích khí (đktc) thu được sau phản ứng.c.Tính tỉ khối lượng muối thu được sau phản ứng. Cho biết Zn=5; H=1; Cl=35,5; O=16
a)
Zn + 2HCl → ZnCl2 + H2
b) nZn = \(\dfrac{3,5}{65}\)=\(\dfrac{7}{130}\) mol
Theo tỉ lệ phản ứng => nH2 = nZn= \(\dfrac{7}{130}\)mol
<=> V H2 = \(\dfrac{7}{130}\).22,4 = 1,206 lít
c) nZnCl2 = nZn => mZnCl2 = \(\dfrac{7}{130}\).136= 7,32 gam
Đúng 2
Bình luận (0)
Cho 6,5g Kẽm (Zn) tác dụng vừa đủ với dung dịch Axit clohidric (HCl) thu được 100ml dung dịch Kẽm clorua (ZnC,) và giải phóng khí Hidro (H2) (đktc). a/- Viết phương trình phản ứng xảy ra.b/- Tìm nồng độ mol Cu của dung dịch ZnCl2.c/- Có bao nhiêu lít khí Hạ được giải phóng.cứu em với
Đọc tiếp
Cho 6,5g Kẽm (Zn) tác dụng vừa đủ với dung dịch Axit clohidric (HCl) thu được 100ml dung dịch Kẽm clorua (ZnC,) và giải phóng khí Hidro (H2) (đktc).
a/- Viết phương trình phản ứng xảy ra.
b/- Tìm nồng độ mol Cu của dung dịch ZnCl2.
c/- Có bao nhiêu lít khí Hạ được giải phóng.
cứu em với![]()
![]()
![]()
\(n_{Zn}=\dfrac{6,5}{65}=0,1\left(mol\right)\)
\(Zn+2HCl\rightarrow ZnCl_2+H_2\uparrow\)
0,1 0,1 0,1
\(b,C_M=\dfrac{0,1}{0,1}=1M\)
\(c,V_{H_2}=0,1.22,4=2,24\left(l\right)\)
Đúng 2
Bình luận (0)
Cho kim loại kẽm(Zn) tác dụng vừa đủ với 250ml dung dịch axit clohiđric (HCl) 2M. Sau phản ứng thu được muối kẽm clorua(ZnCl2) và khí hiđro bay lên. a/Viết phương trình hóa học của phản ứng xảy ra. b/Tính khối lượng kim loại kẽm tham gia phản ứng. c/Tính thể tích khí hiđro sinh ra(đktc).
\(n_{HCl}=0,25.2=0,5\left(mol\right)\\ a,PTHH:Zn+2HCl\rightarrow ZnCl_2+H_2\\ b,n_{Zn}=n_{H_2}=n_{ZnCl_2}=\dfrac{0,5}{2}=0,25\left(mol\right)\\ m_{Zn}=0,25.65=16,25\left(g\right)\\ c,V_{H_2\left(đktc\right)}=0,25.22,4=5,6\left(l\right)\)
Đúng 2
Bình luận (0)
Không biết đúng không nữa;-;;;
a) PTHH: Zn + 2HCl -> ZnCl2 + H2
b) HCl=250ml=0,25l
n2HCl= V/22,4= 0,5/22,4= 0,02(mol)
Zn + 2HCl -> ZnCl2 + H2
1 2 1 1
0,01 <-0,5--------------> 0,01
mZn= n.M= 0,01.65= 0,65(gam)
c) VH2=n . 22,4= 0,01 . 22,4= 0,224(l)
Đúng 0
Bình luận (0)
Cho 5,2g kẽm tác dụng với 5,84g axit clohidric HCl, sau phản ứng thu được 10,88(g) muối kẽm clorua ZnCl2 và V lít khí hidro thoát ra.
a) Hãy lập phương trình hóa học.
b) Tính khối lượng khí hidro thoát ra.
c) Tính V
a) Zn + 2HCl --> ZnCl2 + H2
b) Theo ĐLBTKL: mZn + mHCl = mZnCl2 + mH2
=> mH2 = 5,2 + 5,84 - 10,88 = 0,16 (g)
c) \(n_{H_2}=\dfrac{0,16}{2}=0,08\left(mol\right)\)
=> VH2 = 0,08.22,4 = 1,792(l)
Đúng 1
Bình luận (0)
Hòa tan hoàn toàn 6,5 gam kẽm vào dung dịch axit clohidric HCl có chứa 7,3 gam HCl (vừa đủ). Sau phản ứng thu được dung dịch muối kẽm clorua và 0,2 gam khí hidro,
Viết phản ứng hóa học xảy ra.
Tính khối lượng kẽm clorua Z n C l 2 tào thành.
Cho 13 gam kẽm tác dụng với dung dịch có chứa 14,6 gam axit clohidric HCl thu được dung dịch chứa 27,2 gam kẽm clorua ZnCl2 và khí hidro . a/ Viết công thức về khối lượng của phản ứng xảy ra b/ Tính khối lượng khí hidro bay lên
Đọc tiếp
Cho 13 gam kẽm tác dụng với dung dịch có chứa 14,6 gam axit clohidric HCl thu được dung dịch chứa 27,2 gam kẽm clorua ZnCl2 và khí hidro .
a/ Viết công thức về khối lượng của phản ứng xảy ra
b/ Tính khối lượng khí hidro bay lên
\(PTHH:Zn+2HCl->ZnCl_2+H_2\)
ap dung DLBTKL ta co
\(m_{Zn}+m_{HCl}=m_{ZnCl_2}+m_{H_2}\)
\(=>m_{H_2}=m_{Zn}+m_{HCl}-m_{ZnCl_2}\\ =>m_{H_2}=13+14,6-27,2\\ =>m_{H_2}=0,4\left(g\right)\)
Đúng 1
Bình luận (0)
C1: Cho 3,25 gam kẽm tác dụng với axit clohydric (HCl) loãng.
a) Tính thể tích khí hidro thu được (đktc)?
b) Tính khối lượng muối kẽm clorua (ZnCl2) thu được sau phản ứng?
PTHH : Zn + 2HCl -> ZnCl2 + H2
a, n Zn = m/M = 3,25/65 = 0,05 ( mol )
Theo pthh : n Zn/n H2 = 1/1 ; n Zn/n ZnCl2 = 1/1
=> n Zn = n H2 = n ZnCl2 = 0,05 mol
=> V H2 = n.22,4 = 0,05x22,4= 1,12 ( l )
b, m ZnCl2 = n.M = 0,05 . (65+2.35,5) = 6,8(g)
KL
Hòa tan hoàn toàn 6,5 gam kim loại kẽm bằng 1 lượng vừa đủ dung dịch axit clohidric (HCl), sau phản ứng thu được khí Hidro và muối kẽm clorua (ZnCl2).
a) Viết phương trình hóa học xảy ra?
b) Tính thể tích khí hidro thu được sau phản ứng ở đktc?
c) Tính khối lượng HCl đã phản ứng?
a. \(n_{Zn}=\dfrac{6.5}{65}=0,1\left(mol\right)\)
PTHH : Zn + 2HCl -> ZnCl2 + H2
0,1 0,2 0,1
b. \(V_{H_2}=0,1.22,4=2,24\left(l\right)\)
c. \(m_{HCl}=0,2.36,5=7,3\left(g\right)\)
Đúng 4
Bình luận (0)
\(n_{Zn}=\dfrac{6,5}{65}=0,1mol\)
\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
0,1 0,2 0,1
\(V_{H_2}=0,1\cdot22,4=2,24l\)
\(m_{HCl}=0,2\cdot36,5=7,3g\)
Đúng 2
Bình luận (0)