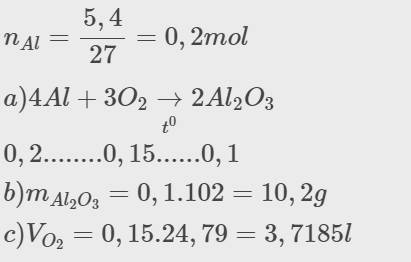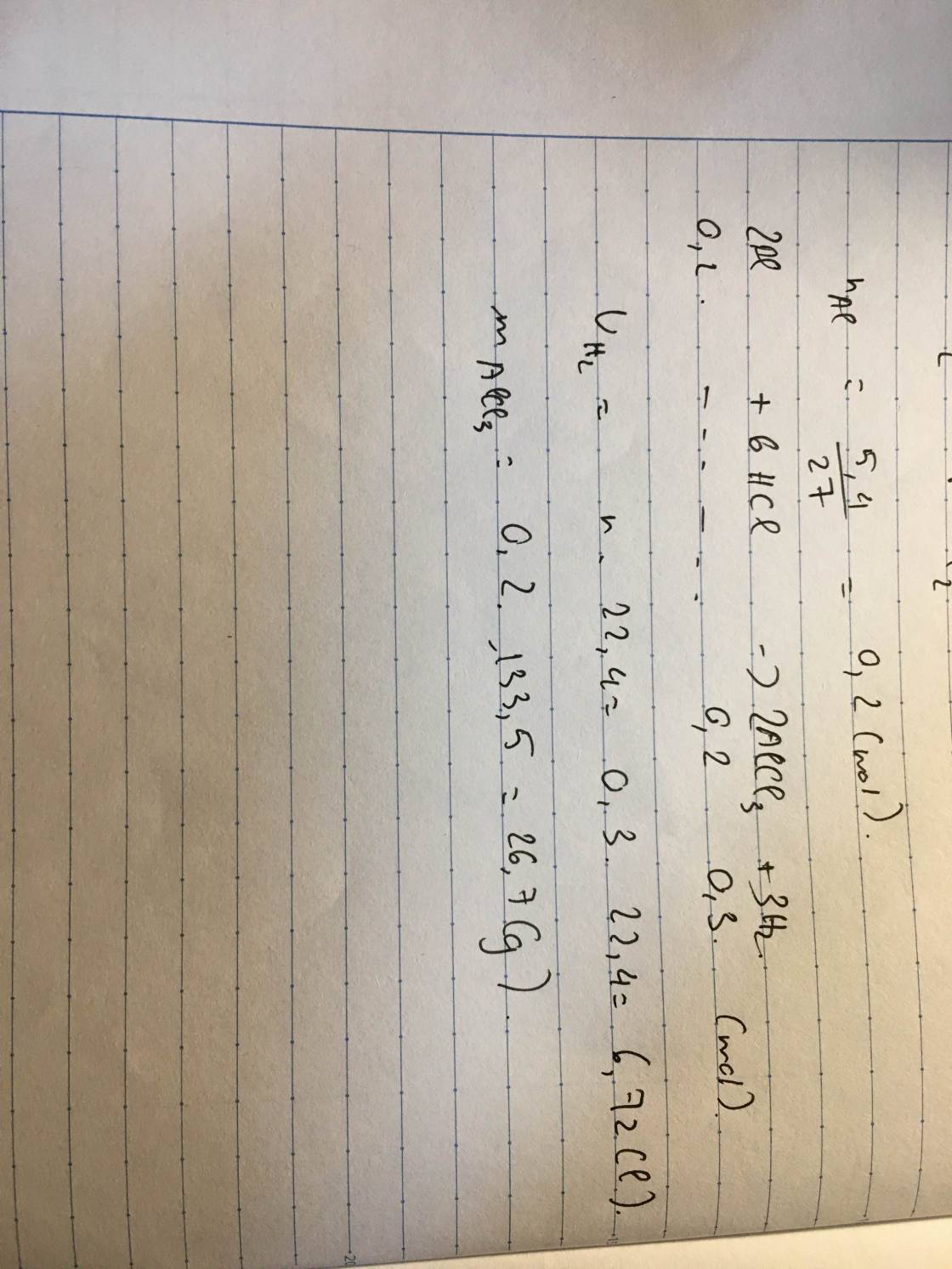Cho 5,4g Al tác dụng với O2 a) Viết phương trình hoá học b) Tính khối lượng sản phẩm

Những câu hỏi liên quan
Cho 5,4g Al tác dụng với O2
a) Viết phương trình hoá học
b) Tính khối lượng sản phẩm
c) tính vo2 ở đkc
\(n_{Al}=\dfrac{5,4}{27}=0,2mol\\ a)4Al+3O_2\xrightarrow[t^0]{}2Al_2O_3\\ 0,2........0,15......0,1\\ b)m_{Al_2O_3}=0,1.102=10,2g\\ c)V_{O_2}=0,15.24,79=3,7185l\)
Đúng 1
Bình luận (0)
Cho 5,4g Al tác dụng với O2 a) Viết phương trình hoá học b) Tính khối lượng sản phẩm c) Tính thể tích O2 ở điều kiện chuẩn
\(n_{Al}=\dfrac{m}{M}=\dfrac{5,4}{27}=0,2\left(mol\right)\)
\(a)PTHH:4Al+3O_2\underrightarrow{t^o}2Al_2O_3\)
4 3 2
0,2 0,15 0,1 (mol)
\(b)m_{Al_2O_3}=n\cdot M=0,1\cdot\left(27\cdot2+16\cdot3\right)=10,2\left(g\right)\\ c)V_{O_2}=n\cdot24,79=0,15\cdot24,79=3,7185\left(l\right).\)
Đúng 1
Bình luận (0)
5,4 g Al tác dụng với O2 .Viết phương trình phản ứng .Tính khối lượng sản phẩm.
11,2 g Fe tác dụng với không khí( điều kiện chuẩn )tạo sắt từ oxit .Viết phương trình phản ứng tính thể tích của không khí (điều kiện chuẩn), khối lượng sản phẩm. Tính m Fe và O2 cần
\(n_{Al}=\dfrac{5.4}{27}=0.2\left(mol\right)\)
\(4Al+3O_2\underrightarrow{^{^{t^0}}}2Al_2O_3\)
Ta có :
\(n_{Al_2O_3}=\dfrac{0.2\cdot2}{4}=0.1\left(mol\right)\)
\(m_{Al_2O_3}=0.1\cdot102=10.2\left(g\right)\)
Đúng 3
Bình luận (0)
\(n_{Fe}=\dfrac{11.2}{56}=0.2\left(mol\right)\)
\(3Fe+2O_2\underrightarrow{^{^{t^0}}}Fe_3O_4\)
\(0.2.......\dfrac{2}{15}.....\dfrac{1}{15}\)
\(V_{O_2}=\dfrac{2}{15}\cdot22.4=2.98\left(l\right)\)
\(m_{Fe_3O_4}=\dfrac{1}{15}\cdot232=15.46\left(g\right)\)
Đúng 2
Bình luận (0)
cho 5,4g bột Al tác dụng với 4,48 l khí o2 (dktc)
a,Sau phản ứng chất nào còn dư?Tính m chất dư
b.Tính khối lượng sản phẩm thu đc
0
\(n_{Al}=\dfrac{5,4}{27}=0,2\left(mol\right)\\ n_{O_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\\a, PTHH:4Al+3O_2\rightarrow\left(t^o\right)2Al_2O_3\\ Vì:\dfrac{0,2}{4}< \dfrac{0,2}{3}\Rightarrow O_2dư\\ \Rightarrow n_{O_2\left(dư\right)}=0,2-\dfrac{3}{4}.0,2=0,05\left(mol\right)\\ \Rightarrow m_{O_2\left(dư\right)}=0,05.32=1,6\left(g\right)\\ b,n_{Al_2O_3}=\dfrac{n_{Al}}{2}=\dfrac{0,2}{2}=0,1\left(mol\right)\\ \Rightarrow m_{Al_2O_3}=102.0,1=10,2\left(g\right)\)
Đúng 4
Bình luận (0)
a, Ta có: \(n_{Al}=\dfrac{5,4}{27}=0,2\left(mol\right)\)
\(n_{O_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
PT: \(4Al+3O_2\underrightarrow{t^o}2Al_2O_3\)
Xét tỉ lệ: \(\dfrac{0,2}{4}< \dfrac{0,2}{3}\), ta được O2 dư.
Theo PT: \(n_{O_2\left(pư\right)}=\dfrac{3}{4}n_{Al}=0,15\left(mol\right)\)
\(\Rightarrow n_{O_2\left(dư\right)}=0,05\left(mol\right)\)
\(\Rightarrow m_{O_2\left(dư\right)}=0,05.32=1,6\left(g\right)\)
b, Theo PT: \(n_{Al_2O_3}=\dfrac{1}{2}n_{Al}=0,1\left(mol\right)\)
\(\Rightarrow m_{Al_2O_3}=0,1.102=10,2\left(g\right)\)
Bạn tham khảo nhé!
Đúng 3
Bình luận (0)
Câu 3. Cho 13g Zinc tác dụng hết với khí Oxygen tạo ra Zinc oxide. a) Viết phương trình hóa học b) Tính khối lượng sản phẩm và thể tích khí O2 cần dùng. c) Tính khối lượng muối KClO3 cần dùng để điều chế lượng O2 trên.
\(n_{Zn}=0,2mol\\ a.2Zn+O_2-^{^{ }t^{^0}}->2ZnO\\ b.m_{ZnO}=0,2.71=14,2g\\ n_{O_2}=0,2:2=0,1mol\\ V_{O_2}=0,1.22,4=2,24L\\ c.2KClO_3-^{^{ }t^{^{ }0}}->2KCl+3O_2\\ n_{KClO_3}=\dfrac{2}{3}.0,1=\dfrac{0,2}{3}mol\\ m_{KClO_3}=122,5\cdot\dfrac{0,2}{3}=8,166g\)
Đúng 3
Bình luận (1)
Cho 5,4g AL tác dụng vừa đủ với dung dịch H2SO4 a) hoàn thành phương trình hoá học b) tính thể tích khí hiđro tạo thành (ở đktc) c) tính khối lượng AL2(SO4)3 tạo thành (Biết AL = 27 , H =1, O=16, S=32) Giúp mình với ạ mình cảm ơn trước
\(n_{Al}=\dfrac{5,4}{27}=0,2mol\)
\(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\)
0,2 0,1 0,3 ( mol )
\(m_{Al_2\left(SO_4\right)_3}=0,1.342=34,2g\)
\(V_{H_2}=0,3.22,4=6,72l\)
Đúng 6
Bình luận (0)
cho 5,4g Al tác dụng với dung dịch axit clohidric tạo ra AlCl3 và khí hidro
a) viết phương trình hóa học
b) tính Vh2 (dktc) thoát ra
c) tính khối lượng AlCl3 tạo thành
giải hộ e với aaa
\(n_{Al}=\dfrac{m}{M}=\dfrac{5,4}{27}=0,2\left(mol\right)\\ PTHH:2Al+6HCl->2AlCl_3+3H_2\)
tỉ lệ 2 : 6 : 2 : 3
n(mol) 0,2---->0,6------->0,2------------->0,3
\(V_{H_2\left(dktc\right)}=n\cdot22,4=0,3\cdot22,4=6,72\left(l\right)\\ m_{AlCl_3}=n\cdot M=0,2\cdot\left(27+35,5\cdot3\right)=26,7\left(g\right)\)
Đúng 3
Bình luận (1)
Đốt cháy hoàn toàn X gam Al trong 3,7185 lít khí O2 (đo ở 25 độ C, áp suất 1 bar) thì thu được sản phẩm Al2O3
A. Viết phương trình hoá học
B. Tính khối lượng Al đã tham gia phản ứng
C. Tính khối lượng sản phẩm Al2O3
a)
4Al + 3O2 --to--> 2Al2O3
b) \(n_{O_2}=\dfrac{3,7185}{24,79}=0,15\left(mol\right)\)
PTHH: 4Al + 3O2 --to--> 2Al2O3
0,2<-0,15------->0,1
=> mAl = 0,2.27 = 5,4 (g)
c) mAl2O3 = 0,1.102 = 10,2 (g)
Đúng 1
Bình luận (0)
Đốt cháy hoàn toàn 10,8 gam Al trong khí O2 thì thu được sản phẩm Al2O3
A. Viết phương trình hoá học
B. Tính thể tích khí O2 đo ở 25 độ C, áp suất 1 bar đã tham gia phản ứng
C. Tính khối lượng sản phẩm Al2O3
a) 4Al + 3O2 --to--> 2Al2O3
b) \(n_{Al}=\dfrac{10,8}{27}=0,4\left(mol\right)\)
PTHH: 4Al + 3O2 --to--> 2Al2O3
0,4-->0,3-------->0,2
VO2(đkc) = 0,3.24,79 = 7,437 (l)
c) mAl2O3 = 0,2.102 = 20,4 (g)
Đúng 2
Bình luận (0)
cho 10,8 g Al tác dụng với 6,048 lít O2 điều kiện tiêu chuẩn
a, Lập phương trình hóa học
b, chất nào còn dư sau phản ứng và dư là bao nhiêu gam
c, Tính khối lượng sản phẩm thu được
\(PTHH:4Al+3O_2->2Al_2O_3\)
BĐ 0,4 0,27 (mol)
PU 0,36---->0,27---->0,18 (mol)
CL 0,04---->0------>0,18 (mol)
b)
\(n_{Al}=\dfrac{m}{M}=\dfrac{10,8}{27}=0,4\left(mol\right)\)
\(n_{O_2}=\dfrac{V}{22,4}=\dfrac{6,048}{22,4}=0,27\left(mol\right)\)
\(\dfrac{n_{Al}}{4}>\dfrac{n_{O_2}}{3}\left(\dfrac{0,4}{4}>\dfrac{0,27}{3}\right)\)
=> Al dư, O2 hết (tính theo O2)
\(m_{Al}=n\cdot M=0,04\cdot27=1,08\left(g\right)\)
c)
\(m_{Al_2O_3}=n\cdot M=0,18\cdot\left(27\cdot2+16\cdot3\right)=18,36\left(g\right)\)
Đúng 2
Bình luận (2)
a, PT: \(4Al+3O_2\underrightarrow{t^o}2Al_2O_3\)
b, Ta có: \(n_{Al}=\dfrac{10,8}{27}=0,4\left(mol\right)\)
\(n_{O_2}=\dfrac{6,048}{22,4}=0,27\left(mol\right)\)
Xét tỉ lệ: \(\dfrac{0,4}{4}>\dfrac{0,27}{3}\), ta được Al dư.
Theo PT: \(n_{Al\left(pư\right)}=\dfrac{4}{3}n_{O_2}=0,36\left(mol\right)\)
\(\Rightarrow n_{Al\left(dư\right)}=0,4-0,36=0,04\left(mol\right)\)
\(\Rightarrow m_{Al\left(dư\right)}=0,04.27=1,08\left(g\right)\)
c, Theo PT: \(n_{Al_2O_3}=\dfrac{2}{3}n_{Al}=0,18\left(mol\right)\)
\(\Rightarrow m_{Al_2O_3}=0,18.102=18,36\left(g\right)\)
Đúng 2
Bình luận (2)